
【题目】某学习小组设计如下装置进行原电池原理的探究。一段时间后取出铜棒洗净,发现浸泡在稀硝酸铜溶液中铜棒变细,浓硝酸铜溶液中铜棒变粗。对该实验的说法正确的是
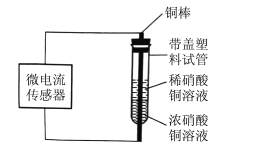
A.处于稀硝酸中的铜棒为电池的正极,电极反应为:Cu2+ +2e- =Cu
B.该装置可以实现“零能耗”镀铜
C.配置上述试验所用硝酸铜溶液应加入适量的硝酸溶液使铜棒溶解
D.铜棒上部电势高,下部电势低
【答案】B
【解析】
原电池,负极发生氧化反应,正极发生还原反应,正极电势比负极电势高。题意中,说明稀硝酸铜中铜作负极,铜变成铜离子进入溶液,下层浓硝酸铜中发生还原反应,铜离子得电子变成铜析出。
A. 题意中稀硝酸铜溶液中铜棒变细,浓硝酸铜溶液中铜棒变粗,说明稀硝酸铜中铜作负极,铜变成铜离子进入溶液,电极反应为: Cu -2e- = Cu2+;A项错误;
B. 稀硝酸铜溶液中铜棒变细,浓硝酸铜溶液中铜棒变粗,这样该装置可以实现“零能耗”镀铜,B项正确;
C. 配置上述试验所用硝酸铜溶液若加如硝酸,硝酸会与铜电极反应,不发生题目中的电化学,C项错误;
D. 铜棒上部为负极,电势低,下部为正极,电势高,D项错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系

据此判断下列说法中正确的是( )
A. CO(g)+H2O(g)===CO2(g)+H2(g) ΔH>0
B. 金刚石比石墨稳定
C. S(g)+O2(g)===SO2(g)ΔH1 , S(s)+O2(g)===SO2(g)ΔH2。则ΔH1>ΔH2
D. 石墨转变为金刚石是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是生产水煤气的反应:C(s)+H2O(g)![]() CO(g)+H2(g)能量变化图,由图可判断下列说法正确的是
CO(g)+H2(g)能量变化图,由图可判断下列说法正确的是
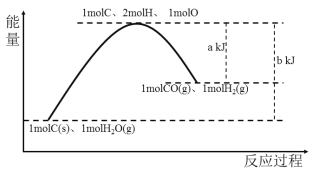
A.容器内充入1molCO、1molH2后充分反应,放出(b-a)kJ的热量
B.C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=-(b-a) kJ·mol -1
CO(g)+H2(g) ΔH=-(b-a) kJ·mol -1
C.该反应过程中既有能量的吸收又有能量的释放
D.加入催化剂可以减小(b-a)的值,从而提高反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种元素,其中:X的负价阴离子核外电子排布和氙原子的核外电子排布相同;Y有两种氧化物,其水溶液呈强碱性,在Y的两种氧化物中,Y的质量分数分别是74.19%和58.79%,这两种氧化物的摩尔质量分别是62g/mol和78g/mol。在X和Y化合生成物的水溶液中滴入Z单质的水溶液,溶液由无色变为深黄色。Z和X在同一主族,相差2个周期。试回答:
(1)写出三种元素的名称:X_________,Y________,Z_________ 。
(2)两种氧化物分别为_________和___________。
(3)Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,其离子方程式为(并标明电子转移方向和数目)_________
(4)X与Y形成的化合物比Z与Y 形成的化合物熔点:________(“高”或“低”)其原因是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对于研究化学物质有十分重要的意义。
(1)已知次磷酸(H3PO2,一元中强酸)和亚磷酸(H3PO3,结构式为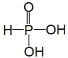 ,二元中强酸)均是重要的精细化工产品。
,二元中强酸)均是重要的精细化工产品。
①写出次磷酸的结构式:_____________________________________。
②已知某温度下0.01 mol·L-1的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的次磷酸溶液混合,混合后溶液pH=7,则此时c(OH-)—c(H3PO2)=___________。(用具体数值表示)
(2)实验室配制FeCl3溶液时,需要将FeCl3固体溶解在较浓的盐酸中,其原因是_______________________________________________________(用离子方程式和必要的文字说明)。
已知25℃时,Fe(OH)3的Ksp=4.0×10-38,配制100ml 5 mol·L-1的FeCl3溶液,至少需要加入_______mL 2 mol·L-1的盐酸(忽略加入盐酸的体积)。
(3)工业废水中的Cr2O72-对生态系统有很大损害。常用的处理方法有两种。
①还原沉淀法:Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3。常温下,要使Cr3+沉淀完全,溶液的pH应调至________。(已知Cr(OH)3的Ksp=10-32)
Cr(OH)3。常温下,要使Cr3+沉淀完全,溶液的pH应调至________。(已知Cr(OH)3的Ksp=10-32)
②电解法:用铁和石墨做电极,电解产生的还原剂将Cr2O72-还原成Cr3+,最终产生Cr(OH)3沉淀。若有1mol Cr2O72-被还原,理论上导线中通过___________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为天然气、页岩气、可燃冰的主要成分,拥有最稳定的烷烃分子结构,具有高度的四面体对称性,极难在温和的条件下对其活化。因此,甲烷的选择活化和定向转化一直是世界性的难题。我国科学家经过长达6年的努力,研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂材料,在室温条件下以H2O2为氧化剂直接将甲烷氧化成C1(只含一个C原子)含氧化合物,被业内认为是甲烷化学领域的重要突破。请回答下列问题:
(1)Cu原子基态原子的外围电子排布式为____________。
(2)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____(减弱”或“不变”)。铁晶体中粒子之间作用力类型是__________________。
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①它们的沸点分别为64.7、-195℃、100.8℃,其主要原因是_________________;
②CH4 和HCHO比较,键角较大的是_________,主要原因是_____________。
(4)配离子的颜色与d-d电子跃迁的分裂能大小有关,1个电子从较低的d轨道跃迁到较高能量的轨道所需的能量为的分裂能,用符号△表示。分裂能△[Co(H2O)62+]_____________△[Co(H2O)63+](填“>”“<”或“=”),理由是_________________。
(5)钴晶胞和白铜(铜镍合金)晶胞分别如图1、图2所示。
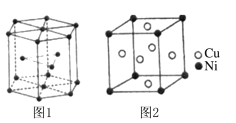
①钴晶胞堆积方式的名称为____________;
②已知白铜晶胞的密度为dg·cm-3 ,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____________pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pC=-lgc;Ksp[Cu(OH)2]=2.2×10-20和Ksp[Mg(OH)2]=1.8×10-11,测得两种金属离子的PC与pH的变化关系如下图所示。下列说法正确的是

A. 加入氨水调节pH可除去MgS04溶液中的CuSO4杂质
B. pH调到Q点则Mg2+和Cu2+都已沉淀完全
C. 在浓度均为1mo/LCuSO4和MgS04的混合溶液中,存在c(Cu2+)+c(Mg2+)>c(S042-)
D. L1代表pC(Cu2+)随pH变化,L2代表pC(Mg2+)随pH变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池装置(见图),下列分析正确的是( )

A. 一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小
B. 原电池工作时,Cu电极流出电子,发生反应:Cu-2e-===Cu2+
C. 原电池工作时,Zn电极发生还原反应:Zn2++2e-===Zn
D. 原电池工作时的总反应为Zn+Cu2+===Zn2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示:
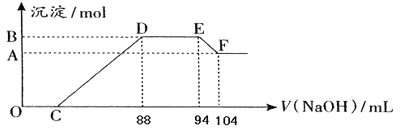
(1)B与A的差值为________mol。
(2)C点对应的溶液体积为________mL。
(3)原硝酸溶液中含硝酸的物质的量为________mol。
(4)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为_______________。
(5)写出铝与该浓度硝酸反应的离子方程式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com