
【题目】化学反应原理对于研究化学物质有十分重要的意义。
(1)已知次磷酸(H3PO2,一元中强酸)和亚磷酸(H3PO3,结构式为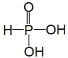 ,二元中强酸)均是重要的精细化工产品。
,二元中强酸)均是重要的精细化工产品。
①写出次磷酸的结构式:_____________________________________。
②已知某温度下0.01 mol·L-1的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的次磷酸溶液混合,混合后溶液pH=7,则此时c(OH-)—c(H3PO2)=___________。(用具体数值表示)
(2)实验室配制FeCl3溶液时,需要将FeCl3固体溶解在较浓的盐酸中,其原因是_______________________________________________________(用离子方程式和必要的文字说明)。
已知25℃时,Fe(OH)3的Ksp=4.0×10-38,配制100ml 5 mol·L-1的FeCl3溶液,至少需要加入_______mL 2 mol·L-1的盐酸(忽略加入盐酸的体积)。
(3)工业废水中的Cr2O72-对生态系统有很大损害。常用的处理方法有两种。
①还原沉淀法:Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3。常温下,要使Cr3+沉淀完全,溶液的pH应调至________。(已知Cr(OH)3的Ksp=10-32)
Cr(OH)3。常温下,要使Cr3+沉淀完全,溶液的pH应调至________。(已知Cr(OH)3的Ksp=10-32)
②电解法:用铁和石墨做电极,电解产生的还原剂将Cr2O72-还原成Cr3+,最终产生Cr(OH)3沉淀。若有1mol Cr2O72-被还原,理论上导线中通过___________mol电子。
【答案】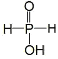 10-7 mol·L-1 ( Fe3++3H2O
10-7 mol·L-1 ( Fe3++3H2O![]() Fe(OH)3+3H+ 加入盐酸可以抑制Fe3+的水解 2.5 5 12
Fe(OH)3+3H+ 加入盐酸可以抑制Fe3+的水解 2.5 5 12
【解析】
(1)①在无机含氧酸中,酸电离出的H+皆来自于酸分子中羟基O-H键的断裂,故一般酸分子中有几个羟基,该酸就是几元酸;
②题中说明次磷酸是中强酸,则其形成的盐溶液中存在水解平衡,列出电荷守恒式、物料守恒式,再作差即可得到题中要求计算的数据;
(2)将FeCl3固体溶解在较浓的盐酸中,是因为盐酸可以抑制Fe3+的水解;题中说明忽略加入盐酸的体积,可认为溶液体积保持不变,根据溶度积的公式可以计算出溶液中OH-的浓度,从而得到H+的浓度,在根据H+的物质的量不变计算;
(3)①当c(Cr3+)≤ 1×10-5mol·L-1时,可认为Cr3+沉淀完全,根据溶度积的公式可以计算出溶液中OH-的浓度,从而得到H+的浓度和溶液pH;②需要认真读题,题中说明还原剂由电解而来,并非Cr2O72-发生电解反应,需要根据Cr2O72-的量来确定还原剂Fe2+的量,从而计算得出导线中通过电子的量。
(1)①含氧酸中的H+都是来自于羟基中O-H键的断裂,亚磷酸中含有两个羟基,故其是二元酸(尽管其含三个氢原子),故一元酸次磷酸含有一个羟基,则其结构式为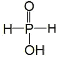 ;
;
②将NaOH溶液与等浓度等体积的次磷酸溶液混合得到NaH2PO2溶液,根据物料守恒有:c(Na+)=c(H3PO2)+c(H2PO2-),根据电荷守恒有:c(Na+)+c(H+)=c(H2PO2-)+c(OH-),将两个守恒式相减可得:c(OH-)-c(H3PO2)=c(H+),由于NaOH溶液和次磷酸溶液混合后溶液pH=7,即溶液中c(H+)=10-7mol·L-1,故c(OH-)-c(H3PO2)= 10-7mol·L-1;
(2)FeCl3溶液中有:Fe3++3H2O![]() Fe(OH)3+3H+,加入盐酸可以抑制Fe3+的水解;由于忽略加入盐酸的体积,所以溶液体积始终为100mL;c(Fe3+)·[c(OH-)]3=Ksp[Fe(OH)3],c(Fe3+)=5mol·L-1,故c(OH-)=
Fe(OH)3+3H+,加入盐酸可以抑制Fe3+的水解;由于忽略加入盐酸的体积,所以溶液体积始终为100mL;c(Fe3+)·[c(OH-)]3=Ksp[Fe(OH)3],c(Fe3+)=5mol·L-1,故c(OH-)=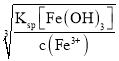 =
=![]() =2×10-13mol·L-1,则c(H+)=
=2×10-13mol·L-1,则c(H+)=![]() =
=![]() =0.05mol·L-1,根据H+的物质的量不变,V(HCl)=
=0.05mol·L-1,根据H+的物质的量不变,V(HCl)=![]() =0.0025L=2.5mL;
=0.0025L=2.5mL;
(3)①当c(Cr3+)≤ 1×10-5mol·L-1时,可认为Cr3+沉淀完全,由于c(Cr3+)·[c(OH-)]3=Ksp[Cr(OH)3],故c(OH-)= =
=![]() =1×10-9mol·L-1,则c(H+)=
=1×10-9mol·L-1,则c(H+)=![]() =
=![]() =1×10-5mol·L-1,即pH=-lg c(H+)=5;
=1×10-5mol·L-1,即pH=-lg c(H+)=5;
②根据反应6Fe2++Cr2O72-+11H2O=6Fe(OH)3↓+2Cr3++4H+可知,1mol Cr2O72-可被6mol Fe2+还原,而Fe2+由Fe放电失去两份电子产生,故1mol Cr2O72-被还原,导线中通过12mol电子。


 核心素养学练评系列答案
核心素养学练评系列答案科目:高中化学 来源: 题型:
【题目】已知: 2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=-226kJ/mol
O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
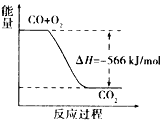
A. CO 的燃烧热为566kJ/mol
B. 上图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H<-452 kJ/mol
D. CO2(g)与Na2O2(s)反应放出452kJ 热量时,电子转移数为1.204×1024 (个)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球影响,以及外界和广口瓶间热量的传递影响)。则所用试剂不可能是( )
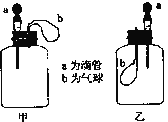
A.H2O和CaO(固体);乙:H2O和NH4NO3(固体)
B.甲:盐酸和Na2O2(固体);乙:亚硫酸钠溶液和氯气
C.甲:NaOH溶液和CO2;乙:盐酸和NaHCO3溶液
D.甲:浓H2SO4和蔗糖(固体);乙:H2O和NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用盐桥电池从某些含碘物质中提取碘的两个装置,下列说法中正确的是( )
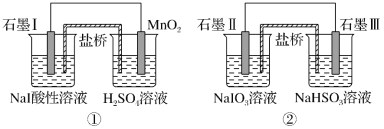
A.两个装置中,石墨I和石墨Ⅱ均作负极
B.碘元素在装置①中被还原,在装置②中被氧化
C.装置①中MnO2的电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D.装置①、②中的反应生成等量的I2时,导线上通过的电子数之比为1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+、B+、C–、D、E五种粒子(分子和离子)中,每个粒子均有10个电子。已知:①A++C–=E+D②B++C–=2D
(1)C–离子的电子式是_________
(2)具有相同空间构型的粒子______和______,E分子的空间构型为_________,_______性分子。
(3)分别写出A+和D反应、B+和E反应的离子方程式_____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计如下装置进行原电池原理的探究。一段时间后取出铜棒洗净,发现浸泡在稀硝酸铜溶液中铜棒变细,浓硝酸铜溶液中铜棒变粗。对该实验的说法正确的是
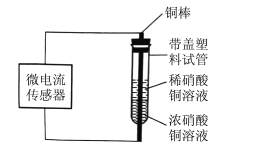
A.处于稀硝酸中的铜棒为电池的正极,电极反应为:Cu2+ +2e- =Cu
B.该装置可以实现“零能耗”镀铜
C.配置上述试验所用硝酸铜溶液应加入适量的硝酸溶液使铜棒溶解
D.铜棒上部电势高,下部电势低
查看答案和解析>>
科目:高中化学 来源: 题型:
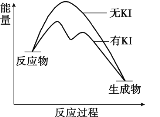
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。
t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下Ka(CH3COOH)>Ka(HClO)、Ksp(AgCl)>Ksp(AgBr)。下列分析不正确的是( )
A.将10 mL 0.1 mol/L Na2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)
B.现有①200 mL 0.1 mol/L NaClO溶液,②100 mL0.1 mol/L CH3COONa溶液,两种溶液中的阴离子的物质的量浓度之和:②>①
C.向0.1 mol/L NH4Cl溶液中加入少量NH4Cl固体:![]() 比值减小
比值减小
D.将AgBr和AgCl的饱和溶液等体积混合,再加入足量AgNO3浓溶液:产生的AgCl沉淀多于AgBr沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子,且所含有的离子浓度均为
中的若干种离子,且所含有的离子浓度均为![]() 。某同学为确定其成分,进行如图所示实验:
。某同学为确定其成分,进行如图所示实验:

下列说法正确的是( )
A.无法确定原试液中是否含有![]() 、
、![]()
B.滤液X中大量存在的阳离子有![]() 、
、![]() 和
和![]()
C.无法确定沉淀C的成分
D.原溶液中存在的离子为![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com