
【题目】下列实验中均需要的仪器是( )
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发.
A.试管
B.胶头滴管
C.玻璃棒
D.漏斗
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂和杀虫剂。一定条件下,恒容密闭容器中,发生反应H2S(g)+CO2(g) ![]() COS(g)+H2O(g),能充分说明该反应已经达到化学平衡状态的是
COS(g)+H2O(g),能充分说明该反应已经达到化学平衡状态的是
A. 正、逆反应速率都等于零
B. H2S、CO2、COS、H2O的浓度相等
C. H2S、 CO2、COS、H2O的浓度不再变化
D. H2S、CO2、COS、H2O在密闭容器中共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析祛处理废液(HCl和FeCl2混合溶液)的原理如图所示,其中X、Y均为离子交换膜。在直流电场的作用下,中间室得到盐酸,阴极区可回收铁。下列说法正确的是
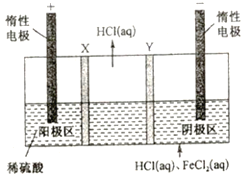
A. X、Y依次是阴离子透过膜和阳离子透过膜
B. 通电后,阴极区溶液的pH不断减小
C. 阳极反应式为2H2O-4e-==4H++O2↑
D. 中间室得到1L2mol/L盐酸时,电路中通过1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有: ①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=206.1kJmol﹣1
②CH4(g)+CO2(g)2CO(g)+2H2(g)△H2=247.3kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=;10min时,改变的外界条件可能是 . 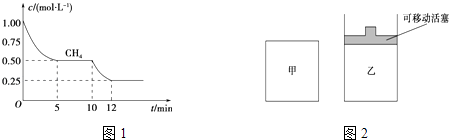
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2 , 使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变. ①可以判断甲容器中反应已达平衡状态的是 .
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是 .
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3= kJmol﹣1 . 800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系是(填代号).
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺. 
(1)①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2 . 写出阳极产生ClO2的电极反应式: . ②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为mol.
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2﹣离子.电池工作时正极反应为 .
(3)若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/molL﹣1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3溶液存在水解平衡:CO32﹣+H2OHCO3﹣+OH﹣ . 下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
B.通入CO2 , 平衡朝正反应方向移动
C.升高温度, ![]() 减小
减小
D.加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应A(g)+B(g)![]() 2C(g)+D(s)△H>0,向1L绝热容器中加入1molA和1molB发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
2C(g)+D(s)△H>0,向1L绝热容器中加入1molA和1molB发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
①单位时间内消耗amolA,同时生成2amolC
②混合气体的总压强不再变化
③混合气体的密度不再变化
④A、B、C的分子数之比为1∶1∶2
⑤反应容器中温度不变
⑥A的转化率与B的转化率相等时
A. ①②④⑥ B. ②④⑥ C. ①④⑥ D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料。
(1)不同温度、压强下.合成该平衡体系NH3的物质的量分数如图 (N2和H2的起始物质的量之比为1:3)。
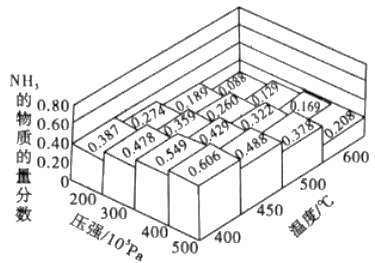
①分析图中数据,升高温度,该反应的平衡常数K值____(填“增大”“减小”或“不变”)。
②如果开始时向密闭容器中投入1.0mol N2 和3.0mol H2,则在500℃、3×107Pa条件下达到平衡时N2 的平衡转化率=_______。(保留两位有效数字)
③液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3 ![]() NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
(2)以氨气代替氢气研发氨清洁燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液。该电池负极的电极反应式为_________________。
(3)NH3也是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的NH3转化为氮气除去,其相关反应的热化学方程式如下:
反应I: NH3 (aq)+HClO(aq)=NH2Cl(aq)+H2O(l) △H1=akJ/mol;
反应II :NH2Cl(aq)+HClO(aq)=NHCl2(aq) +H2O(l) △H2=bkJ/mol;
反应III: 2NHCl2(aq) +H2O(l)=N2(g)+HClO( aq)+3HCl( aq) △H3=ckJ/mol。
①2NH3(aq)+3HClO(aq)==N2 (g)+3HCl(aq)+3H2O(l) △H=________kJ/mol
②已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件不变的情况下,改变![]() 对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图所示。a点之前溶液中发生的主要反应为_______(填序号)。
对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图所示。a点之前溶液中发生的主要反应为_______(填序号)。
A.反应I、I I B.反应I

③除氨氮过程中最佳的![]() 值约为______________。
值约为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com