
【题目】对可逆反应A(g)+B(g)![]() 2C(g)+D(s)△H>0,向1L绝热容器中加入1molA和1molB发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
2C(g)+D(s)△H>0,向1L绝热容器中加入1molA和1molB发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
①单位时间内消耗amolA,同时生成2amolC
②混合气体的总压强不再变化
③混合气体的密度不再变化
④A、B、C的分子数之比为1∶1∶2
⑤反应容器中温度不变
⑥A的转化率与B的转化率相等时
A. ①②④⑥ B. ②④⑥ C. ①④⑥ D. ①②⑥
【答案】C
【解析】根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
①单位时间内消耗amolA,同时生成2amolC,都体现正反应方向,错误;
②两边气体计量数相等,但反应绝热,温度变化,所以混合气体的总压强不再变化时说明反应达到平衡状态,正确;
③混合气体的密度不再变化,说明气体的质量不变,反应达平衡状态,正确;
④A、B、C的分子数之比为1:1:2,不能说明达平衡状态,错误;
⑤反应绝热,温度变化,反应容器中温度不变时反应达到平衡状态,正确;
⑥A的转化率与B的转化率相等时不一定达到平衡状态,错误。
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于电解质的叙述,正确的是( )
A.NaCl溶液在电流作用下电离出Na+和Cl-
B.凡是溶于水后能电离出H+的化合物就叫酸
C.HCl溶液能导电,而液态的HCl难以导电
D.难溶物一定不属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种元素的原子,其价电子排布分别为4s2、3s2 3p2 和2s2 2p4,由这三种元素组成的化合物的化学式可能是
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)2SO2(g)+O2(g)2SO3(g)反应过程的能虽变化如图所示.己知1mol SO2(g)氧化为1mol SO3(g)的△H=﹣99kJ/mol. 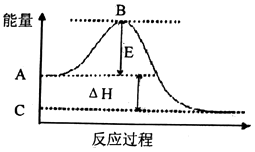
请回答下列问题:
①E的大小对该反应的反应热(填“有”或“无”)影构.
②图中△H=kJ/mol.
(2)由氢气和氧气反应生成1mol水蒸气,放出241.8kJ热量(25℃、101kPa下测得) ①写出该反应的热化学方程式: .
②若lmol水蒸气转化为液态水放热45kJ,则反应H2(g)+ ![]() O2(g)=H2O(l)的△H=kJ/mol.
O2(g)=H2O(l)的△H=kJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的叙述中,不正确的是( )
A.氯化钠和氯化铯晶体中,阳离子的配位数均为6
B.金刚石为三维网状结构,由碳原子以sp3杂化轨道形成共价键
C.金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)是一种重要的化工原料,工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3 2PCl3+O2=2POCl3
PCl3、POCl3的部分性质如下:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |
某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去) :
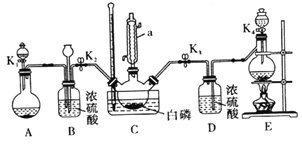
(1)仪器a 的名称为_______________,B装置中长颈漏斗的作用是___________________。
(2)装置E用来制取Cl2,反应的离子方程式为_____________________。
(3)为使实验顺利进行,还需补充的装置为____________________。
(4)反应时,需严格控制三个条件:
①先制取___________,缓慢地通入C 中,直至C 中的白磷消失后,再通入另一种气体。
②C装置用水浴加热控制温度为60 ℃~65℃,除加快反应速率外,另一目的是___________________。
③反应物必须干燥,否则会在C 装置中产生大量的白雾,其主要成分为___________(写化学式)。
(5)反应结束后通过下面步骤测定POCl3产品中Cl 的含量,元素Cl 的质量分数为_______________(写出计算式)。
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH 溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000 mol/L 的AgNO3 溶液40.00 mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用c mol/LNH4SCN溶液滴定过量Ag+ 至终点,记下所用体积为VmL。
(己知:AgPO4溶于酸,Ksp(AgCl )=32×10-10,Ksp(AgSCN )=2×10-12)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com