
| 催化剂 |
| △ |
| ||
| 催化剂 |
| △ |
| 0.182 |
| 0.022×0.01 |
| ||


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
| A、稀盐酸 |
| B、Ba(OH)2溶液 |
| C、NaOH溶液 |
| D、Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.9 g 2CaSO4?H2O中含有的结晶水分子数为0.02NA |
| B、30 g乙酸和葡萄糖的混和物中含碳原子数为NA |
| C、在铁与硫的反应中,1 mol铁失去的电子数为3NA |
| D、62 g Na2O溶于水后所得溶液中含有的O2-数为NA足量溶液A充分反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
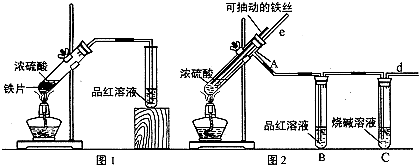
查看答案和解析>>
科目:高中化学 来源: 题型:
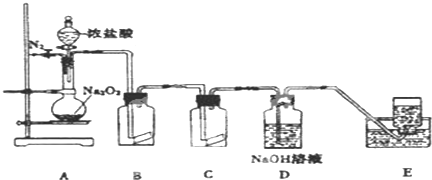
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B单质可能是金属,也可能是非金属 |
| B、B与A形成的化合物一定是离子化合物 |
| C、C单质只有氧化性 |
| D、原子半径:C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:
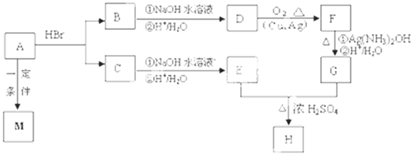
查看答案和解析>>
科目:高中化学 来源: 题型:
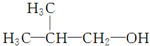 )和甲酸在一定条件下制取E.该反应的化学方程式是
)和甲酸在一定条件下制取E.该反应的化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
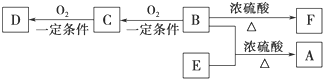
| ||
| A、①中MnO2和H2SO4都是氧化剂 |
| B、MnSO4的还原性小于Zn的还原性 |
| C、②中MnSO4发生氧化反应 |
| D、硫酸在该生产中可循环利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com