
【题目】中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转换关系(部分产物未列出),单质A常作为食品包装材料,甲是两性氧化物。
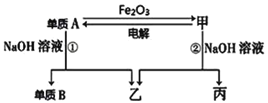
根据图示转化关系回答:
(1)写出单质A与Fe2O3反应的化学方程式__________________________________
(2)写出电解甲制单质A的化学方程式__________________________________
(3)实验室完成单质A与Fe2O3反应实验,需要的试剂还有_______。
a.KCl b.KClO 3 c.MnO2 d.Mg
(4)利用单质A与Fe2O3反应的原理,工业上可用于___________
【答案】2Al+Fe2O3![]() 2Fe +Al2O3 2Al2O3(熔融)
2Fe +Al2O3 2Al2O3(熔融)![]() 4Al+3O2↑ bd 焊接钢轨等
4Al+3O2↑ bd 焊接钢轨等
【解析】
根据物质间的转化关系分析物质的组成,根据物质的性质判断发生的化学反应及书写相关反应方程式。
甲是两性氧化物,甲为Al2O3,单质A常作为食品包装材料,单质A与NaOH溶液反应生成单质B,结合图示的转化关系,则A为铝,B为氢气,乙为偏铝酸钠,丙为水;
(1)Al与Fe2O3的反应为铝热反应,化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3;
2Fe+Al2O3;
(2)电解熔融氧化铝反应方程式为:2Al2O3(熔融)![]() 4Al+3O2↑ ;
4Al+3O2↑ ;
(3)铝热反应实验,需要点燃镁条,和氯酸钾提供氧气,故此题选的试剂还有bd;
(4)铝热反应放出大量的热,使得生成的铁融化,所以工业上可用于焊接钢轨等。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

实验测得OH定问移向B电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
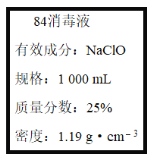
(1)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L-1。
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是____(填字母)。
a.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
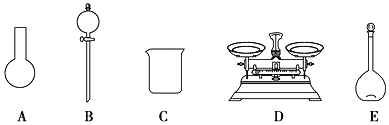
b.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
d.需要称量NaClO固体的质量为143.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):
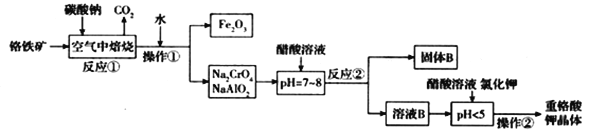
(1)反应①中,焙烧时所用的仪器材质应选用_______(填“瓷质”、“铁质”或“石英质”)。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ____________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ____________________。
(3)加入醋酸溶液,调节溶液的pH < 5时,发生的反应是___________(写离子方程式).
(4)下表是相关物质的溶解度数据:
物质 | 溶解度( g / 100 g H2O ) | ||
0 ℃ | 40 ℃ | 80 ℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
①调节pH < 5后,加入KCl固体经一系列操作析出K2Cr2O7晶体的理由是______________。
②获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)酸性溶液中过氧化氢能使Cr2O72生成蓝色的CrO5,该反应可用来检验Cr2O72的存在。已知该反应是非氧化还原反应,写出反应的离子方程式:________________,CrO5分子结构中过氧键的数目是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
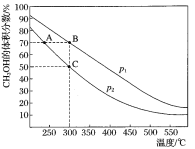
A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向饱和苛性钠溶液中放一定量的过氧化钠,充分反应后恢复到原温度,下列有关说法中,正确的是
A.溶液中Na+浓度增大,有O2放出B.溶液pH不变,有H2放出
C.溶液中Na+数目减少,有O2放出D.溶液中pH增大,有O2放出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com