
【题目】祖母绿被称为绿宝石之王,是国际珠宝世界公认的四大名贵宝石之一,其化学式为Be3Al2Si6O18。回答下列问题:
(1)基态Be原子的电子排布图为____________,基态Al原子核外电子占据________个轨道,其中能量最高能级的原子轨道的形状为__________。
(2)Al、Si、O的第一电离能由大到小的排序为____________________。
(3)SO3分子中硫原子的杂化类型是_____,SO3分子的空间构型是________。
(4)工业上,电解制取金属铝,不能用熔融的AlCl3,AlCl3的晶体类型是__________,将Be3Al2Si6O18写为氧化物的式子是_____________________。
(5)LiAlH4在有机合成中可将羧基还原成羟基。甲酸和乙醇的熔、沸点如图所示:
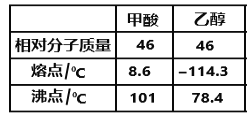
1mol甲酸分子中σ键与π键的比值为________________,甲酸和乙醇的熔点相差较大的主要原因是____________________________________________。
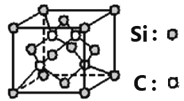
(6)碳化硅的晶体类型类似金刚石,晶胞结构如图所示。已知:碳化硅的晶体密度为ag/cm3,NA代表阿伏伽德罗常数的数值。该晶胞边长为_____________pm。
【答案】![]() 7 哑铃(或纺锤)形 O>Si>Al sp2 平面正三角形 分子晶体 Al2O33BeO6SiO2(或3BeOAl2O36SiO2) 4:1 甲酸分子间氢键比乙醇分子间氢键强
7 哑铃(或纺锤)形 O>Si>Al sp2 平面正三角形 分子晶体 Al2O33BeO6SiO2(或3BeOAl2O36SiO2) 4:1 甲酸分子间氢键比乙醇分子间氢键强 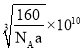
【解析】
(1) Be为4号元素,Al为13号元素,结合电子排布式分析解答;
(2) 同一周期,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素。同族元素,从上至下第一电离能逐渐减小,据此排序;
(3)根据价层电子对个数=σ键个数+孤电子对个数=σ键个数+![]() (a-xb)计算判断SO3分子中硫原子的杂化类型和空间构型;
(a-xb)计算判断SO3分子中硫原子的杂化类型和空间构型;
(4) AlCl3为共价化合物,熔点较低;结合硅酸盐改为氧化物的方法改写;
(5)根据共价单键为σ键,共价双键中一个是σ键、一个是π键计算甲酸分子中σ键与π键数目之比;分子间形成氢键会导致物质熔沸点升高,甲酸中羧基上的两个O原子均可形成氢键,比乙醇分子间氢键强;
(6)根据均摊法计算碳化硅晶胞中Si原子和C原子个数,求出晶胞的质量,在根据晶体密度计算晶胞边长。
(1) Be为4号元素,基态Be原子的电子排布图为![]() ,Al为13号元素,基态Al原子核外电子排布式为1s22s22p63s23p1,占据7个轨道,其中能量最高能级的原子轨道为3p,形状为哑铃(或纺锤)形,故答案为:
,Al为13号元素,基态Al原子核外电子排布式为1s22s22p63s23p1,占据7个轨道,其中能量最高能级的原子轨道为3p,形状为哑铃(或纺锤)形,故答案为:![]() ;7;哑铃(或纺锤)形;
;7;哑铃(或纺锤)形;
(2) 同一周期,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素。同族元素,从上至下第一电离能逐渐减小,Al、Si、O的第一电离能由大到小的排序为O>Si>Al,故答案为:O>Si>Al;
(3)SO3分子中硫原子的价层电子对数=3+![]() =3,杂化类型为sp2杂化,SO3分子的空间构型是平面正三角形,故答案为:sp2;平面正三角形;
=3,杂化类型为sp2杂化,SO3分子的空间构型是平面正三角形,故答案为:sp2;平面正三角形;
(4)工业上,电解制取金属铝,不能用熔融的AlCl3,是因为AlCl3为共价化合物,熔融状态不能导电,AlCl3的熔点较低,属于分子晶体;将Be3Al2Si6O18写为氧化物的式子为Al2O33BeO6SiO2(或3BeOAl2O36SiO2),故答案为:分子晶体;Al2O33BeO6SiO2(或3BeOAl2O36SiO2);
(5)甲酸的结构简式为HCOOH,分子中共价单键为σ键,共价双键中一个是σ键、一个是π键,所以甲酸分子中σ键与π键数目之比=4∶1;分子间形成氢键会导致物质熔沸点升高,甲酸中羧基上的两个O原子均可形成氢键,比乙醇分子间氢键强,所以甲酸熔沸点高于乙醇,故答案为:4∶1;甲酸分子间氢键比乙醇分子间氢键强;
(6)碳化硅晶胞中Si原子个数=8×![]() +6×
+6×![]() =4,C原子个数为4,晶胞的质量为
=4,C原子个数为4,晶胞的质量为![]() g,晶体密度为ag/cm3,则晶胞边长=
g,晶体密度为ag/cm3,则晶胞边长=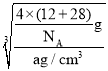 =
=![]() cm=
cm=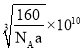 pm,故答案为:
pm,故答案为: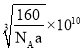 。
。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、L、M,原子序数依次递增。X是原子半径最小的元素,Y的最高正价和最低负价的代数和为0,Z的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应,L的最外层电子数是次外层的3倍,M是地壳中含量最高的金属元素。
回答下列问题:
(1)五种元素的原子半径从大到小的顺序是______(用元素符号表示)。
(2)X能分别与Y、Z、L形成具有相同电子数的化合物A、B、C。实验室制取B的化学方程式为______。
(3)Z的最高价氧化物对应水化物与M的最高价氧化物对应水化物反应的离子方程式为_______。
(4)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于元素周期表中下列位置的①~⑩10种元素,请用元素符号或化学式回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | ② | ||||||
二 | ③ | ④ | ⑤ | ⑥ | ||||
三 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑦在元素周期表中的位置____________。
(2)以上元素所形成的最高价含氧酸酸性最强的酸是____________,(填化学式,下同)碱性最强的碱是____________。它们与⑨的单质反应的离子方程式分别为____________、____________。
(3)④⑤⑥的原子半径的由大到小顺序为____________。(填元素符号)③④⑤⑥的最简单氢化物的稳定性由弱到强的顺序为____________。
(4)⑤⑦的一种1:1型化合物X的电子式为____________。X能和①⑤组成的一种化合物Y反应生成⑤的单子,则化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是

A. x的数值为2×10-5
B. c点时有CaCO3生成
C. 加入蒸馏水可使溶液由d点变成 a点
D. b点与d点对应的溶度积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+ 6H2(g) ![]() CH3OCH3(g) + 3H2O(l),该反应化学平衡常数表达式K = ________________________。
CH3OCH3(g) + 3H2O(l),该反应化学平衡常数表达式K = ________________________。
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图
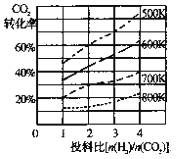
①该反应的ΔH ________ 0(填“>"或“<”)。
②若温度不变,减小反应投料比[n(H2)/n(CO2)],K值将________(填“增大”、“减小”或“不变”)。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是__________。
A.混气的颜色 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0 mol CO2 6.0 mol H2 | 0.10 mol | 0.04 mol | 0.02 mol |
II.1.0 mol CO2 3.0 mol H2 | X1 | Y1 | Z1 |
III.1.0 mol CH3OCH3 3.0 mol H2O | X2 | Y2 | Z2 |
①P1 ________ P3(填“>”“<”或“=”);
②P2下,III中CH3OCH3的平衡转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/c2(CH3OH),该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式:_________________________________ 。
(2)该反应的△H _________0。
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此时温度400℃,则某时刻υ正_______υ逆(填<、>或=,下同)。
②若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中____点,比较图中B、D两点所对应的正反应速率υB_______υD,理由是____。

(4)一定条件下要提高反应物的转化率,可以采用的措施是___________。
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医药阿斯匹林的结构简式如图。试回答:
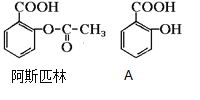
(1)阿斯匹林可看成酯类物质,口服后在胃肠作用下,阿斯匹林发生水解反应,生成A和B两种产物。其中A的结构简式如图,则阿斯匹林的分子式为:____________,B的结构简式为:_______,B中的官能团是:____________(名称)。
(2)上述水解产物B与甲醇、浓硫酸共热反应的化学方程式为:____________。
(3)甲醇在铜作催化剂时与氧气反应的化学方程式为:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com