
【题目】某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.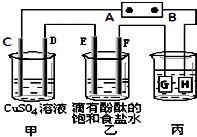
(1)B为电源的极;
(2)在电解一段时间后在甲中加入适量可以使溶液恢复到原来的浓度.
(3)在常温下,现用丙装置给铁镀铜,当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为(假设溶液体积为1L);
(4)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4 , 若将该反应设计为原电池,其正极电极反应式为 .
【答案】
(1)正
(2)CuO或CuCO3
(3)13
(4)4H++O2+4e﹣═2H2O
【解析】解:在C电极表面有铜析出,则C为阴极,可知A为负极,B为正极,则C、E、G为阴极,D、F、H为阳极,(1)在C电极表面有铜析出,则C为阴极,可知A为负极,B为正极,所以答案是:正极;
(2.)甲中发生的反应:2CuSO4+2H2O ![]() 2Cu+O2+2H2SO4 , 由方程式知,电解出的物质有Cu和O2 , 所以加入CuO或CuCO3可以使溶液恢复到原来的浓度,但Cu(OH)2或碱式碳酸铜会使溶液变稀,不能恢复到原来的浓度,所以答案是:CuO或CuCO3;
2Cu+O2+2H2SO4 , 由方程式知,电解出的物质有Cu和O2 , 所以加入CuO或CuCO3可以使溶液恢复到原来的浓度,但Cu(OH)2或碱式碳酸铜会使溶液变稀,不能恢复到原来的浓度,所以答案是:CuO或CuCO3;
(3.)n(Cu)=3.2g÷64g/mol=0.05mol,
丙中:
Cu2+ | + | 2e﹣ | = | Cu |
0.1mol | 0.05mol |
整个装置中电子的得失数相等,故乙中转移电子数也为0.1mol,
乙中的电解反应式为:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑,
阴极电极方程式为:
2H2O | + | 2e﹣ | = | 2OH﹣ | + | H2↑ |
0.1mol | 0.1mol |
故c(OH﹣)=0.1 mol/L,c(H+)=1×10﹣13 mol/L,pH=13,
所以答案是:13;
(4.)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:4H++O2+4e﹣═2H2O,所以答案是:4H++O2+4e﹣═2H2O.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便。下列各组物质中,符合“氧化物—酸—碱—盐”顺序排列的是
A.CO HNO3 NaOH KNO3 B.CO2 H2CO3 Na2CO3 Ca(HCO3)2
C.H2SO4 HCl Mg(OH)2 MgCl2 D.SO3 NaHCO3 NaOH Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
(1)升高温度,反应速率将_________,平衡将如何移动 ;
(2)加入正催化剂,反应速率将_________,平衡将如何移动 ;
(3)充入更多的H2,反应速率将_________,平衡将如何移动 ;
(4)扩大容器的体积,反应速率将_________,平衡将如何移动 ;
(5)容器体积不变,通入氖气,反应速率将___________,平衡将如何移动 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校兴趣小组拟用如图1装置制取Cl2(气密性已检验,试剂已添加),并研究其相关性质. 
(1)写出烧瓶内反应的化学方程式
(2)欲证明干燥的Cl2无漂白性而HClO有漂白性,实验方案为: .
(3)将生成的氯气通过图2装置: ①观察到图2丙中的现象是 . 能证明发生此变化是由HClO的漂白性引致的实验是 .
②取20mL图2乙中的溶液加入锥形瓶中,加入足量的KI溶液,以淀粉液为指示剂,用浓度为0.01000mol/L的Na2S2O3溶液滴定,消耗Na2S2O3溶液的体积为25.00mL.则饱和食盐水中Cl2的含量为g/L(忽略其中的HClO,结果保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4 . 一种MnO2制备KMnO4的方法如下: 
(1)写出“溶化氧化”的化学反应方程式:;
(2)从溶液②中得到KMnO4粗晶体的方法是;
(3)上述流程中可以循环使用的物质是;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因: ①不采用盐酸的原因:;
②不采用硫酸的原因:
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法: ①在K2MnO4溶液中通入氯气,写出该反应的离子方程式;
②电解K2MnO4溶液,电解的总反应离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是____________(填序号)。
a.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
b.高温使水分解制氢:2H2O(g)![]() 2H2+O2
2H2+O2
c.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
d.天然气制氢:CH4+H2O(g)![]() CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示。
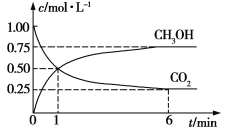
①从1 min到6 min,v(H2)=__________mol·L1·min1。
②能说明上述反应达到平衡状态的是_______(填编号)。
a.总压强保持不变
b.混合气体的密度不随时间的变化而变化
c.H2的体积分数在混合气体中保持不变
d.单位时间内消耗3 mol H2,同时生成1 mol H2O
e.反应中CO2与H2的物质的量之比为1∶3且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应A2(g)+B2(g)![]() 2AB(g)达到平衡状态的标志是:( )
2AB(g)达到平衡状态的标志是:( )
A. 单位时间内生成 n mol A2,同时生成 n mol AB
B. 体系内的总压不随时间变化
C. 单位时间内生成2n mol AB的同时生成n mol B2
D. 单位时间内生成 n mol A2的同时,生成n mol B2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:
(1)该流程中可以循环的物质是 .
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42﹣等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水.
①第一次精制过程中所加除杂试剂顺序不合理的是
A.BaCl2、NaOH、Na2CO3、HCl B.BaCl2、Na2CO3、NaOH、HCl
C.NaOH、BaCl2、Na2CO3、HCl D.Na2CO3、BaCl2、NaOH、HCl
②一次精制后的食盐水仍会有少量的Ca2+、Mg2+ , 需要送入阳离子交换塔进行二次精制,若不经过二次精制,直接进入离子膜电解槽,这样会产生什么后果 .
(3)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成),则A处产生的气体是 , F电极的名称是 . 电解总反应的离子方程式为 .
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 .
(5)已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3 , 电解槽的电流强度1.45×104A,该电解槽的电解效率为(保留两位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合物分离的方法在生产、生活和科学实验中有着广泛的应用。请指出下列做法中分别应用了哪些分离方法?(请把答案填写在横线上)
(1)除去豆浆中的颗粒物杂质_______________ (2)用海水晒盐________________
(3)除去豆油中的水_____________________ (4)从碘水中提取碘__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com