
【题目】MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4 . 一种MnO2制备KMnO4的方法如下: 
(1)写出“溶化氧化”的化学反应方程式:;
(2)从溶液②中得到KMnO4粗晶体的方法是;
(3)上述流程中可以循环使用的物质是;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因: ①不采用盐酸的原因:;
②不采用硫酸的原因:
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法: ①在K2MnO4溶液中通入氯气,写出该反应的离子方程式;
②电解K2MnO4溶液,电解的总反应离子方程式为 .
【答案】
(1)3MnO2+6KOH+KClO3 ![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
(2)蒸发浓缩,冷却结晶,过滤
(3)MnO2
(4)![]()
(5)盐酸具有还原性,高锰酸钾具有氧化性会产生氯气;硫酸钾溶解度低,在蒸发浓缩过程中容易析出而造成高锰酸钾产品纯度下降
(6)Cl2+2MnO42﹣=2MnO4﹣+2Cl﹣;2MnO42﹣+2H2O ![]() 2MnO4﹣+H2↑+2OH﹣
2MnO4﹣+H2↑+2OH﹣
【解析】解:MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,溶于水得到溶液①,K2MnO4溶液经加入稀醋酸酸化后转化为MnO2和KMnO4 . 过滤得到滤渣为MnO2 , 滤液为溶液②蒸发浓缩,冷却结晶,过滤,干燥得到KMnO4晶体;(1)由软锰i随高锰酸钾矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,反应中化合价变化的元素为Mn、Cl,Mn元素由+4价升高为+6,Cl元素化合价由+5降低为﹣1,根据化合价升降相等,则二氧化锰与氯酸钾的物质的量之比为3:1,再根据原子守恒配平方程式为:3MnO2+6KOH+KClO3 ![]() 3K2MnO4+KCl+3H2O, 所以答案是:3MnO2+6KOH+KClO3
3K2MnO4+KCl+3H2O, 所以答案是:3MnO2+6KOH+KClO3 ![]() 3K2MnO4+KCl+3H2O;(2)由溶液得到晶体,需要蒸发浓缩,冷却结晶,即步骤③的操作为蒸发浓缩,冷却结晶,过滤洗涤得到KMnO4晶体,
3K2MnO4+KCl+3H2O;(2)由溶液得到晶体,需要蒸发浓缩,冷却结晶,即步骤③的操作为蒸发浓缩,冷却结晶,过滤洗涤得到KMnO4晶体,
所以答案是:蒸发浓缩,冷却结晶;(3)上述过程中MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,溶于水得到溶液①,K2MnO4溶液经加入稀硫酸酸化后转化为MnO2和KMnO4 . 过滤得到滤渣为MnO2 , 循环使用的物质为二氧化锰,
所以答案是:MnO2;(4)(4)3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O,K2MnO4转变为MnO2和KMnO4 , 离子反应为4H++3MnO42﹣═MnO2+2MnO4﹣+2H2O,得到定量关系为:
3K2MnO4+KCl+3H2O,K2MnO4转变为MnO2和KMnO4 , 离子反应为4H++3MnO42﹣═MnO2+2MnO4﹣+2H2O,得到定量关系为:
3MnO2~ | 2KMnO4 |
3 | 2 |
1mol |
|
所以答案是: ![]() ;(5)①不采用盐酸的原因是盐酸具有还原性,高锰酸钾具有氧化性,二者混合反应生成污染性的气体氯气,
;(5)①不采用盐酸的原因是盐酸具有还原性,高锰酸钾具有氧化性,二者混合反应生成污染性的气体氯气,
所以答案是:盐酸具有还原性,高锰酸钾具有氧化性,反应生成氯气;
②已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,硫酸钾溶解度低,在蒸发浓缩过程中容易析出而造成高锰酸钾产品纯度下降,
所以答案是:硫酸钾溶解度低,在蒸发浓缩过程中容易析出而造成高锰酸钾产品纯度下降;(6)①在K2MnO4溶液中通入氯气,氯气氧化K2MnO4为高锰酸钾,反应的离子方程式为:Cl2+2MnO42﹣=2MnO4﹣+2Cl﹣ ,
所以答案是:Cl2+2MnO42﹣=2MnO4﹣+2Cl﹣;
②电解K2MnO4溶液,阳极是MnO42﹣失电子发生氧化反应生成MnO4﹣ , 阴极是氢离子得到电子生成氢气,结合电荷守恒、原子守恒配平书写电解反应,反应的离子方程式为:2MnO42﹣+2H2O ![]() 2MnO4﹣+H2↑+2OH﹣;
2MnO4﹣+H2↑+2OH﹣;
所以答案是:2MnO42﹣+2H2O ![]() 2MnO4﹣+H2↑+2OH﹣ .
2MnO4﹣+H2↑+2OH﹣ .


科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中,错误的是
A.胶体的本质特征是其分散质粒子直径为1~100 nm
B.胶体是胶状的纯净化合物
C.利用丁达尔效应可区分溶液和胶体
D.将饱和FeCl3溶液滴入沸水中,再煮沸可形成红褐色的胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿法炼锌为现代炼锌的主要方法,下列是以硫化锌精矿为原料制备单质锌的工业流程. 
(1)烟气不能直接排放,可用于制取一种常见的强酸,该强酸为 .
(2)浸出液以硫酸锌为主,还含有Fe 3+、Fe 2+、A1 3+、Cu 2+、Cd 2+、C1一等杂质,会影响锌的电解,必须除去.净化过程如下:
①在酸性条件下,用H2O2将Fe2+氧化成Fe3+ , 离子方程式为 .
②将浸出液的pH调节为5.5左右,使Fe3+、A13+形成沉淀而除去,可选用的最佳试剂为(填字母)
A.NaOH B.NH3H2 O C.ZnOH D.H2SO4
③用Zn除去Cu2+和Cd2+
④用Ag2SO4除去Cl一 , 发生的离子方程式为, .
(3)用两支惰性电极插入500mL硫酸锌溶液中,通电电解.当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),锌在极析出,其质量为mg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH 随溶液体积变化的曲线如图所示,则下列叙述不正确的是( ) 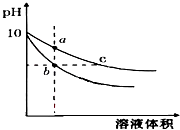
A.b、c两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vb=Vc
D.c点溶液中C(H+)+C(CH3COOH)=C(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成分为Fe(CrO2)2 , 含有Al2O3、SiO2等杂质]为主要原料生产重要铬铁矿KClO3、纯碱CO2氧化剂重铬酸钠晶体(Na2Cr2O72H2O)的主要工艺流程如图: 
(1)浸出液中的主要成分为Na2CrO4 . 写出煅烧时主要成分[Fe(CrO2)2]发生反应的化学方程式;同时杂质Al2O3、SiO2液转化为可溶性盐,在浸出液中分别以、(离子符号)存在.
(2)酸化的目的是将Na2CrO4转化为Na2Cr2O7 . 写出反应的离子方程式:; 通过结晶分离得到的Na2Cr2O72H2O中可能含有的杂质除了Na2SO4外,还有 . 进一步提纯的方法是 .
(3)根据有关国家标准,含CrO42﹣的废水要经化学处理,使其浓度降至5.0×10﹣7mol/L以下才能排放.含CrO42﹣的废水处理通常有以下两种方法. ①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10﹣10],再加入可溶性硫酸盐处理多余的Ba2+ . 加入可溶性钡盐后的废水中Ba2+的浓度应不小于mol/L,后续废水处理方能达到国家排放标准.
②还原法:CrO42﹣ ![]() Cr3+
Cr3+ ![]() Cr(OH)3 . 用该方法处理10m3 CrO42﹣的物质的量浓度为1.5×10﹣3mol/L的废水,至少需要绿矾(FeSO47H2O)kg.
Cr(OH)3 . 用该方法处理10m3 CrO42﹣的物质的量浓度为1.5×10﹣3mol/L的废水,至少需要绿矾(FeSO47H2O)kg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.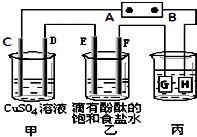
(1)B为电源的极;
(2)在电解一段时间后在甲中加入适量可以使溶液恢复到原来的浓度.
(3)在常温下,现用丙装置给铁镀铜,当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为(假设溶液体积为1L);
(4)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4 , 若将该反应设计为原电池,其正极电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效 率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH 溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连 续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: 
(1)写出氢氧燃料电池工作时负极反应方程式: .
(2)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和 H2O反应生成 H2 和 CO 的化学方程式: .
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 .
电池总离子反应方程式为
(4)若将此燃料电池改进为直接以有机物 A 和氧气为原料进行工作,有机物 A 只含有 C、H、O 三种元素,常用作有机合成的中间体.16.8g 该有机物经燃烧生成 44.0g CO2 和 14.4g H2O;质谱图表明其相对分子质量为 84,红外光谱分析表明 A 分子中含有 O﹣H 键和位于分子端的﹣C≡C﹣键,核磁共振氢谱有三个峰,峰面积为 6:1:1.A 的分子式是 . A的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.I A族元素都是金属元素
B.在第三周期主族元素中Na的原子半径最大
C.焰色反应是一种复杂的化学变化
D.碱金属元素的化合物焰色反应均显黄色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com