
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效 率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH 溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连 续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: 
(1)写出氢氧燃料电池工作时负极反应方程式: .
(2)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和 H2O反应生成 H2 和 CO 的化学方程式: .
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 .
电池总离子反应方程式为
(4)若将此燃料电池改进为直接以有机物 A 和氧气为原料进行工作,有机物 A 只含有 C、H、O 三种元素,常用作有机合成的中间体.16.8g 该有机物经燃烧生成 44.0g CO2 和 14.4g H2O;质谱图表明其相对分子质量为 84,红外光谱分析表明 A 分子中含有 O﹣H 键和位于分子端的﹣C≡C﹣键,核磁共振氢谱有三个峰,峰面积为 6:1:1.A 的分子式是 . A的结构简式是 .
【答案】
(1)2H2+4OH﹣﹣4e﹣═4H2O
(2)C3H8+3H2O ![]() 3CO+7H2
3CO+7H2
(3)CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;CH4+2O2+2OH﹣═CO32﹣+3H2O
(4)C5H8O;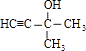
【解析】解:(1)氢氧燃料电池中,电解质溶液为碱,则负极上氢气得电子生成水,则其电极反应式为:2H2+4OH﹣﹣4e﹣═4H2O,所以答案是:2H2+4OH﹣﹣4e﹣═4H2O;(2)丙烷和 H2O反应生成 H2 和 CO,反应的化学方程式为C3H8+3H2O ![]() 3CO+7H2 , 所以答案是:C3H8+3H2O
3CO+7H2 , 所以答案是:C3H8+3H2O ![]() 3CO+7H2;(3)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲烷在负极生成碳酸根离子,其电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;碱性条件下,甲烷燃烧生成的二氧化碳再与氢氧根离子结合生成碳酸根离子,则总反应方程式为CH4+2O2+2OH﹣═CO32﹣+3H2O,
3CO+7H2;(3)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲烷在负极生成碳酸根离子,其电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;碱性条件下,甲烷燃烧生成的二氧化碳再与氢氧根离子结合生成碳酸根离子,则总反应方程式为CH4+2O2+2OH﹣═CO32﹣+3H2O,
所以答案是:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;CH4+2O2+2OH﹣═CO32﹣+3H2O;(4)有机物A只含有C、H、O三种元素,质谱图表明其相对分子质量为84,16.8g有机物A的物质的量为0.2mol,经燃烧生成44.0g CO2 , 物质的量为1mol,生成14.4g H2O,物质的量为 ![]() =0.8mol,故有机物A中C原子数目为
=0.8mol,故有机物A中C原子数目为 ![]() =5,H原子数目为
=5,H原子数目为 ![]() =8,故氧原子数目为
=8,故氧原子数目为 ![]() =1,故A的分子式为C5H8O,
=1,故A的分子式为C5H8O,
不饱和度为 ![]() =2,红外光谱分析表明A分子中含有O﹣H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,故分子中含有2个CH3、1个﹣OH连接在同一C原子上,故A的结构简式为
=2,红外光谱分析表明A分子中含有O﹣H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,故分子中含有2个CH3、1个﹣OH连接在同一C原子上,故A的结构简式为 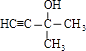 ,
,
所以答案是:C5H8O; 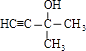 .
.


科目:高中化学 来源: 题型:
【题目】等质量的两块钠,第一块在氧气中加热生成Na2O2,第二块在足量氧气 (常温)中充分反应生成Na2O,则下列说法正确的是
A.第一块钠失去电子多B.两块钠失去电子一样多
C.第一块钠的反应产物质量大D.两块钠的反应产物质量一样大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4 . 一种MnO2制备KMnO4的方法如下: 
(1)写出“溶化氧化”的化学反应方程式:;
(2)从溶液②中得到KMnO4粗晶体的方法是;
(3)上述流程中可以循环使用的物质是;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因: ①不采用盐酸的原因:;
②不采用硫酸的原因:
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法: ①在K2MnO4溶液中通入氯气,写出该反应的离子方程式;
②电解K2MnO4溶液,电解的总反应离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应A2(g)+B2(g)![]() 2AB(g)达到平衡状态的标志是:( )
2AB(g)达到平衡状态的标志是:( )
A. 单位时间内生成 n mol A2,同时生成 n mol AB
B. 体系内的总压不随时间变化
C. 单位时间内生成2n mol AB的同时生成n mol B2
D. 单位时间内生成 n mol A2的同时,生成n mol B2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加0.1 mol MnO2粉末于50 mL过氧化氢溶液(H2O2,ρ=1.1 g·mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。

(1)实验时放出气体的总体积是 。
(2)放出一半气体所需时间为 。
(3)A、B、C、D各点反应速率由快到慢的顺序为 。
(4)解释反应速率变化的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:
(1)该流程中可以循环的物质是 .
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42﹣等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水.
①第一次精制过程中所加除杂试剂顺序不合理的是
A.BaCl2、NaOH、Na2CO3、HCl B.BaCl2、Na2CO3、NaOH、HCl
C.NaOH、BaCl2、Na2CO3、HCl D.Na2CO3、BaCl2、NaOH、HCl
②一次精制后的食盐水仍会有少量的Ca2+、Mg2+ , 需要送入阳离子交换塔进行二次精制,若不经过二次精制,直接进入离子膜电解槽,这样会产生什么后果 .
(3)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成),则A处产生的气体是 , F电极的名称是 . 电解总反应的离子方程式为 .
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 .
(5)已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3 , 电解槽的电流强度1.45×104A,该电解槽的电解效率为(保留两位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示,下列说法正确的是( ) 
A.元素O的单质存在O2和O3两种同位素
B.加入催化剂,减小了H2O2分解反应的热效应
C.若H2O2分解产生1molO2 , 理论上转移4mol电子
D.H2O2和Na2O2所含化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 摩尔质量就等于物质的式量 B. 摩尔质量就是物质式量的6.02×1023倍
C. HNO3的摩尔质量是63g D. 硫酸和磷酸的摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.I A族元素都是金属元素
B.在第三周期主族元素中Na的原子半径最大
C.焰色反应是一种复杂的化学变化
D.碱金属元素的化合物焰色反应均显黄色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com