
����Ŀ���ȼҵ��������Ļ�ѧ��ҵ֮һ������Ĥ��ⷨΪĿǰ�ձ�ʹ�õ�����������������������ͼ1��ʾ��
��1���������п���ѭ���������� ��
��2����ⷨ�Ƽ����Ҫԭ���DZ���ʳ��ˮ�����ڴ���ˮ�к���Ca2+��Mg2+��SO42���������ʣ������ڽ������ǰ��Ҫ�������ξ��ƣ��õ����Ʊ���ʳ��ˮ��
�ٵ�һ�ξ��ƹ��������ӳ����Լ�˳��������
A��BaCl2��NaOH��Na2CO3��HCl B��BaCl2��Na2CO3��NaOH��HCl
C��NaOH��BaCl2��Na2CO3��HCl D��Na2CO3��BaCl2��NaOH��HCl
��һ�ξ��ƺ��ʳ��ˮ�Ի���������Ca2+��Mg2+ �� ��Ҫ���������ӽ��������ж��ξ��ƣ������������ξ��ƣ�ֱ�ӽ�������Ĥ���ۣ����������ʲô��� ��
��3��ͼ2�ǹ�ҵ�ϵ�ⱥ��ʳ��ˮ�����ӽ���Ĥ����ʾ��ͼ�������ý��������Ƴɣ�������̼�����Ƴɣ�����A�������������� �� F�缫�������� �� ����ܷ�Ӧ�����ӷ���ʽΪ ��
��4���������۳����ĵ���ˮ�У����������������ܽ��ȣ���Ҫ����8%��9%������������Һ���䳹�׳�ȥ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��5����֪�ڵ����У�ÿСʱͨ��1A��ֱ���������Ͽ��Բ���1.492g���ռij������300�����۴�������8h���Ƶ�32%���ռ���Һ���ܶ�Ϊ1.342t/m3��113m3 �� ���۵ĵ���ǿ��1.45��104A���õ��۵ĵ��Ч��Ϊ��������λС������
���𰸡�
��1���Ȼ��ơ���������
��2��D�����Լ����������ˮ�л���������Mg2+��Ca2+ �� ���������»����ɳ����������ӽ���Ĥ
��3��H2��������2Cl��+2H2O ![]() Cl2��+H2��+2OH��
Cl2��+H2��+2OH��
��4��Na2SO3+Cl2+H2O=Na2SO4+2HCl
��5��93.45%
���������⣺��1�����ݹ�������ͼ�����õ���ԭ���Լ��������֪���Ȼ��ơ����������ǿ���ѭ��ʹ�õģ����Դ��ǣ��Ȼ��ơ��������ƣ���2�����ȼ���������NaOH����ȥþ���ӣ�Ȼ��������BaCl2 �� ��ȥSO42����CO32�����ټ������Na2CO3 ��ȥCa2+������Ba2+�����˺���Һ�м�����������ᣬ��ȥ��Һ��ʣ���̼��������������е��������������ȳ�ȥʣ����Ȼ��⣬Ҳ���ȼ�BaCl2 �� �ټ���NaOH����Ӧ��֤��������μ���Na2CO3��HCl��Ϊ�˽���������ʳ�����̼���Ʊ�������Ȼ����ĺ��棬��D����
���Դ��ǣ�D���ڴ��������ˮ�л�����������������Mg2+��Ca2+ �� ���������»����ɳ�������װ���еĽ���Ĥ����Ӱ�죬
���Դ��ǣ����Լ����������ˮ�л���������Mg2+��Ca2+ �� ���������»����ɳ����������ӽ���Ĥ����3�������У���������������������������B�ǵ�Դ�ĸ�����A��������E���������������ϲ���������������ⱥ��ʳ��ˮ��ԭ������ʽΪ��2Cl��+2H2O ![]() Cl2��+H2��+2OH�� �� ���Դ��ǣ�H2��������2Cl��+2H2O
Cl2��+H2��+2OH�� �� ���Դ��ǣ�H2��������2Cl��+2H2O ![]() Cl2��+H2��+2OH������4���������������ԣ��ܽ�������������Ϊ�����ƣ���Na2SO3+Cl2+H2O=Na2SO4+2HCl�����Դ��ǣ�Na2SO3+Cl2+H2O=Na2SO4+2HCl����5���ռ���Һ����Ϊ1.342��103kg/m3��113m3=1.516��105kg��
Cl2��+H2��+2OH������4���������������ԣ��ܽ�������������Ϊ�����ƣ���Na2SO3+Cl2+H2O=Na2SO4+2HCl�����Դ��ǣ�Na2SO3+Cl2+H2O=Na2SO4+2HCl����5���ռ���Һ����Ϊ1.342��103kg/m3��113m3=1.516��105kg��
m��NaOH��=1.516��105kg��32%=4.85��104kg��
����������Ҫ������Ϊ ![]() =3.252��107A��
=3.252��107A��
��ʵ���Ϻĵ���Ϊ1.45��104A��8��300=3.48��107A��
�õ��۵ĵ��Ч��Ϊ ![]() ��100%=93.45%��
��100%=93.45%��
���Դ��ǣ�93.45%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ȳ��C2H2��������C6H6������ȩ��C2H4O���Ļ�������к���Ԫ�ص���������Ϊ8%������������̼Ԫ�ص���������Ϊ�� ��
A.84%
B.60%
C.91%
D.42%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ͬѧ����ͼװ�ý���ʵ�飬һ��ʱ�����C�缫������ͭ�������Իش��������⣮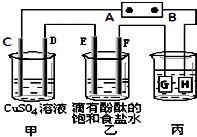
��1��BΪ��Դ������
��2���ڵ��һ��ʱ����ڼ��м�����������ʹ��Һ�ָ���ԭ����Ũ�ȣ�
��3���ڳ����£����ñ�װ�ø�����ͭ������������������ͭ��3.2gʱ��������Һ��PHֵΪ��������Һ���Ϊ1L����
��4�����÷�Ӧ2Cu+O2+2H2SO4�T2CuSO4+2H2O���Ʊ�CuSO4 �� �����÷�Ӧ���Ϊԭ��أ��������缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С�����ݷ�Ӧ AsO43��+2H++2I��AsO33��+I2+H2O�����ͼԭ��أ�̽��pH��AsO43�������Ե�Ӱ�죮��õ�ѹ��pH�Ĺ�ϵ��ͼ�������й�����������ǣ� �� 
A.pH=0.68ʱ����Ӧ����ƽ��״̬
B.����pH���Ըı䷴Ӧ�ķ���
C.pH��0.68ʱ�������缫��ӦʽΪ2I����2e ���TI2
D.pH=5ʱ��������I2��AsO43��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ�ı�δ�������ʮ���¿Ƽ�֮һ��ȼ�ϵ�ؾ�������Ⱦ������������Ч �ʵ��ص㣮��ͼΪ����ȼ�ϵ�صĽṹʾ��ͼ���������ҺΪKOH ��Һ���缫����Ϊ���ɶ��ʯī�����������������ֱ��� �����ϵش�����������ͨ��ȼ�ϵ��ʱ������ڱպϻ�·�в��ϵز����������Իش��������⣺ 
��1��д������ȼ�ϵ�ع���ʱ������Ӧ����ʽ�� ��
��2��Ϊ�˻�����������˳������̫�����⣬��ҵ������ʯ�Ͳ�Ʒ��ˮ�ڸ��¡�������������ȡ������д������� H2O��Ӧ���� H2 �� CO �Ļ�ѧ����ʽ�� ��
��3��������ȼ�ϵ�ظĽ�Ϊֱ���Լ��������Ϊԭ�Ͻ��й���ʱ��������ӦʽΪ ��
��������ӷ�Ӧ����ʽΪ
��4��������ȼ�ϵ�ظĽ�Ϊֱ�����л��� A ������Ϊԭ�Ͻ��й������л��� A ֻ���� C��H��O ����Ԫ�أ��������л��ϳɵ��м��壮16.8g ���л��ᆳȼ������ 44.0g CO2 �� 14.4g H2O������ͼ��������Է�������Ϊ 84��������������� A �����к��� O��H ����λ�ڷ��Ӷ˵ĩ�C��C�������˴Ź��������������壬�����Ϊ 6��1��1��A �ķ���ʽ�� �� A�Ľṹ��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PCT��һ�����;������ϣ��ṹ��ʽΪ�� ![]() ��ij�о�С���÷�����AΪԭ�Ϻϳ�PCT�ĺϳ�·�����£�
��ij�о�С���÷�����AΪԭ�Ϻϳ�PCT�ĺϳ�·�����£� 
�ش��������⣺
��1��A�������� �� ��Ӧ�ٵĻ�ѧ����ʽΪ �� A�������������ԭ�ӹ�ƽ�森
��2��C�Ľṹ��ʽ�� �� ��Ӧ�۵������� ��
��3��E���еĹ������� �� ��Ӧ��������PCT�⣬��������һ�ֿ���ѭ�����õ��л�����л�������д�ṹ��ʽ����
��4��C��ͬ���칹�������ڱ��Ķ�Ԫȡ����������FeCl3��Һ������ɫ��Ӧ�Ĺ����֣�E��ͬ���칹���У��ܷ���ˮ�ⷴӦ�ұ�����һ�ȴ�����ֻ��һ�ֵ�����д�ṹ��ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����У����ۼ����ƻ�����
A.ľ̿����������B.�ɱ�����
C.����������ˮD.�Ȼ�������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϊͬλ�ص�����ԭ�Ӳ����ܾ���
A. ��ͬ�ĵ�����B. ��ͬ��������
C. ������ȫ��ͬ�Ļ�ѧ����D. ��ͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ķ���������������Ϳ�ѧʵ�������Ź㷺��Ӧ�á���ָ�����������зֱ�Ӧ������Щ���뷽��������Ѵ���д�ں����ϣ�
��1����ȥ�����еĿ���������_______________ ��2���ú�ˮɹ��________________
��3����ȥ�����е�ˮ_____________________ ��4���ӵ�ˮ����ȡ��__________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com