
【题目】已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为( )
A.84%
B.60%
C.91%
D.42%
【答案】A
【解析】解:乙醛(C2H4O)可以表示为C2H2 . H2O,故乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体可以看做C6H6、C8H8、C2H2、H2O的混合物,O元素的分数为8%,故H2O的质量分数为 ![]() =9%,故C6H6、C8H8、C2H2总的质量分数1﹣9%=91%,由三种物质的化学式可知最简式为CH,C、H质量之比为12:1,故C元素的质量分数为91%×
=9%,故C6H6、C8H8、C2H2总的质量分数1﹣9%=91%,由三种物质的化学式可知最简式为CH,C、H质量之比为12:1,故C元素的质量分数为91%× ![]() =84%,故选A.
=84%,故选A.
乙醛(C2H4O)可以表示为C2H2 . H2O,故乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体可以看做C6H6、C8H8、C2H2、H2O的混合物,根据O元素的分数计算H2O的质量分数,进而计算C6H6、C8H8、C2H2总的质量分数,由三物质的化学式可知最简式为CH,C、H质量之比为12:1,据此计算C元素的质量分数.


科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
①CS2为V形的极性分子
②ClO3﹣的空间构型为平面三角形
③SF6中有6对完全相同的成键电子对
④SiF4和SO32﹣的中心原子均为sp3杂化.
A.①②
B.②③
C.③④
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,请填写下列空格: 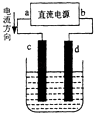
(1)C电极是极,发生反应的是(填微粒符号),该微粒在反应中电子(“得”或“失”),发生反应(“氧化”或“还原”),反应现象为 , 电极反应式 .
(2)总方程式为
(3)上述电解反应中,被氧化的物质是 , 被还原的物质是(填化学式).
(4)在化学反应中发生的能量转化形式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素最高正价与负价绝对值之差为4,该元素的离子跟与其核外电子排布相同的离子形成的化合物是( )
A. K2SB. MgSC. Na2OD. NaF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和 H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 ![]() 、
、 ![]() 、
、 ![]() 分别表示N2、H2、NH3 , 下列说法正确的是( )
分别表示N2、H2、NH3 , 下列说法正确的是( ) 
A.使用催化剂,合成氨反应放出的热量减少
B.在该过程中,N2、H2断键形成N原子和H原子
C.在该过程中,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )
A.CH4 C2H4
B.CH4 C3H4
C.C2H4 C3H4
D.C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为NA
B.常温常压下,1.06gNa2CO3含有的Na+数为0.02NA
C.通常状况下,NA个CO2分子占有的体积为22.4L
D.标准状况下,22.4LH2O含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大 , 原因是 .
(2)哪一段时段的反应速率最小 , 原因是
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率 .
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:你认为可行的是(填编号). A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 常温时硅化学性质不活泼,不能与任何物质反应
B. 晶体硅具有金属光泽,可以导电,属于金属材料
C. Na2SiO3是制备硅胶和木材防火剂的原料
D. 二氧化硅是将太阳能转化为电能的常用材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com