
【题目】某元素最高正价与负价绝对值之差为4,该元素的离子跟与其核外电子排布相同的离子形成的化合物是( )
A. K2SB. MgSC. Na2OD. NaF
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】105℃、101kPa时,甲烷、乙烷和乙烯组成的混合烃80mL与过量O2混合并完全燃烧,恢复到原来的温度和压强,混合气体总体积增加了30mL。原混合烃中乙烷的体积分数为
A. 12.5%B. 25%C. 50%D. 75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化银胶体中的分散质粒子实际上是一个个由很多“AgCl”结合而成的集合体.向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔效应,则下列分析正确的是( ) 
A.该区域是A,该区域中AgCl的直径最小
B.该区域是B,该区域中AgCl的直径介于
A.C区域之间
B.该区域是C,该区域中AgCl的直径最大
C.各区域AgCl的大小都相同,但只有B区域中分散质的大小介于1~100 nm之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W,X,Y,Z的原子序数依次增大,W,X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) 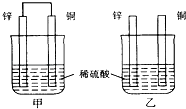
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的氢离子浓度均减小
D.产生气泡的速度甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂.从废钒催化剂中回收V2O5既避免污染环境
又有利于资源综合利用.废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+ , 反应的离子方程式为 , 同时V2O4转成VO2+ . “废渣1”的主要成分是 .
(2)“氧化”中欲使3 mol的VO2+变为VO2+ , 则需要氧化剂KClO3至少为mol.
(3)“中和”作用之一是使钒以V4O124﹣形式存在于溶液中.“废渣2”中含有 .
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124﹣![]() R4V4O12+4OH﹣(以ROH为强碱性阴离子交换树脂).为了提高洗脱效率,淋洗液应该呈性(填“酸”“碱”“中”).
R4V4O12+4OH﹣(以ROH为强碱性阴离子交换树脂).为了提高洗脱效率,淋洗液应该呈性(填“酸”“碱”“中”).
(5)“流出液”中阳离子最多的是 .
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为( )
A.84%
B.60%
C.91%
D.42%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾(CuSO45H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是( )
A.将胆矾加热除去结晶水后,称取16g溶解在1L水中
B.称取25g胆矾溶于水,然后将此溶液稀释至1L
C.称取25g胆矾溶解在1L水里
D.将16g胆矾溶于水,然后将此溶液稀释至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
A.放电时负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
B.放电时正极反应为:FeO ![]() +4H2O+3e﹣═Fe(OH)3+5OH﹣
+4H2O+3e﹣═Fe(OH)3+5OH﹣
C.放电时正极附近溶液的碱性增强
D.放电时每转移3mol电子,正极有1molK2FeO4被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com