
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
A.放电时负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
B.放电时正极反应为:FeO ![]() +4H2O+3e﹣═Fe(OH)3+5OH﹣
+4H2O+3e﹣═Fe(OH)3+5OH﹣
C.放电时正极附近溶液的碱性增强
D.放电时每转移3mol电子,正极有1molK2FeO4被氧化
科目:高中化学 来源: 题型:
【题目】某元素最高正价与负价绝对值之差为4,该元素的离子跟与其核外电子排布相同的离子形成的化合物是( )
A. K2SB. MgSC. Na2OD. NaF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大 , 原因是 .
(2)哪一段时段的反应速率最小 , 原因是
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率 .
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:你认为可行的是(填编号). A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国“9·11”恐怖袭击给纽约带来了一场严重的环境灾害-石棉污染,易使吸入石棉纤维者患肺癌。已知石棉是硅酸盐矿物,某种石棉的化学式可表示为Ca2MgxSiyO22(OH)2,x、y的值可能分别为( )
A. 8、3B. 5、8C. 3、8D. 9、8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代传感信息技术在化学实验中有广泛的应用.某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图1所示),并测定电离平衡常数Kb. 
(1)实验室可用浓氨水和X固体制取NH3 , X固体可以是
A.生石灰
B.无水氯化钙
C.五氧化二磷
D.碱石灰
(2)检验三颈瓶集满NH3的方法是 .
(3)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c口, , 引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2所示.图2中点时喷泉最剧烈.
(4)从三颈瓶中用(填仪器名称)量取20.00mL氨水至锥形瓶中,用0.05000mol/L HC1滴定.用pH计采集数据、电脑绘制滴定曲线如图3所示.
(5)据图3计算,当pH=11.0时,NH3H2O电离平衡常数Kb近似值,Kb .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用.
(1)已知:①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+206.1kJmol﹣1
②2H2(g)+CO(g)CH3OH(l)△H2=﹣128.3kJmol﹣1
③2H2(g)+O2(g)2H2O (g)△H3=﹣483.6kJmol﹣1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为 .
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa).
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/molL﹣1 | H2O初始浓度/molL﹣1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2K3(填“>”、“<”或“=”).
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为 .
(3)科学家提出由CO2制 取 C的太阳能工艺如图1所示.
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为 .
②“热分解系统”中每分解l mol Fe xOy , 转移电子的物质的量为 . 
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值.若某溶液中溶质的浓度为1×10﹣3molL﹣1 , 则该溶液中溶质的pC=﹣lg(1×10﹣3)=3.如图2为25℃时H2CO3溶液的pC﹣pH图.请回答下列问题 (若离子浓度小于10﹣5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3﹣、CO32﹣(填“能”或“不能”)大量共存.
②求H2CO3一级电离平衡常数的数值Ka1= .
③人体血液里主要通过碳酸氢盐缓冲体系 ![]() 可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4.当过量的酸进入血液中时,血液缓冲体系中的 ![]() 最终将 .
最终将 .
A.变大B.变小C.基本不变D.无法判断.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 常温时硅化学性质不活泼,不能与任何物质反应
B. 晶体硅具有金属光泽,可以导电,属于金属材料
C. Na2SiO3是制备硅胶和木材防火剂的原料
D. 二氧化硅是将太阳能转化为电能的常用材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于甲烷与氯气反应的叙述有
①常温下,产物一氯甲烷是气体,其他3种氯代产物都是液体;
②二氯甲烷只有一种的事实证明了甲烷不是平面正方形;
③实验室可以通过排饱和食盐水的方法收集甲烷和氯气;
④如果把收集好甲烷和氯气的试管放在日光直射的地方,可能会发生爆炸;
⑤光照时,试管中甲烷和氯气的混合气体的颜色逐渐变浅,试管壁出现油状液滴,试管中有少量白雾。其中正确的是
A. ①②③④⑤B. ①②③C. ②③④D. ①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)用铜、银与硝酸银设计一个原电池,此电池的负极是 , 负极的电极反应式是 .
(2)如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒. 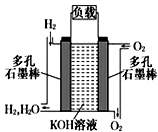
根据所学知识试回答下列问题:
①写出氢氧燃料电池工作时正极电极反应方程式: .
②如果该氢氧燃料电池每转移1mol电子,消耗标准状况下氧气的体积为 .
③阳离子向极移动(填写正或负),反应一段时间后整个溶液的碱性(填增强,减弱或者不变).
④若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com