
【题目】下列溶液一定呈酸性的是( )
A.含有较多H+的溶液
B.pH<7的溶液
C.c(OH﹣)<c(H+)的溶液
D.滴加酚酞显无色溶液
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:
【题目】利用下图所示装置可以将温室气体![]() 转化为燃料气体CO。下列说法正确的是
转化为燃料气体CO。下列说法正确的是
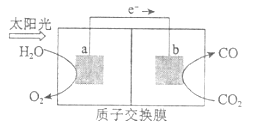
A. 该过程是将太阳能转化为化学能的过程
B. 电极a表面发生还原反应
C. 该装置工作时, ![]() 从b极区向a极区移动
从b极区向a极区移动
D. 该装置中每生成![]() ,同时生成
,同时生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质。如图是元素周期表的一部分。
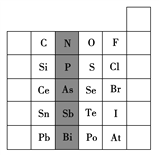
(1)阴影部分元素N在元素周期表中的位置为____周期第____族。根据元素周期律,预测酸性强弱:H3AsO4____H3PO4(填“>”或“<”)。
(2)S的最高化合价和最低化合价的代数和为____,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的程度比S与H2反应程度____(填“更大”“更小”或“相同”)。
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是____。
(4)下列说法错误的是____(填序号)。
①C、N、O、F的原子半径随着原子序数的增大而减小
②Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
③干冰升华、液态水转变为气态水都要克服分子内的共价键
④HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图与表述一致的是( )
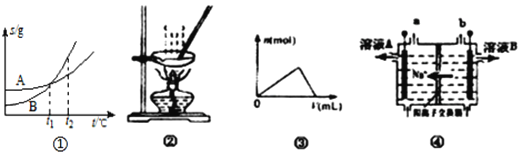
A. 图①表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A
B. 用图②所示装置蒸发FeCl3溶液制备无水FeCl3
C. 图③可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化
D. 图④电解饱和食盐水的装置中,溶液B为浓氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用MgCl2、AlCl3混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:

(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应容器中加入_________(填“A”、或“B”),再滴加另一反应物。
(2)写出实验室制取氨气的化学方程式______________________________________________。
(3)判断流程中沉淀是否洗净所用的试剂是_______________;高温焙烧时,用于盛放固体的仪器名称是______________。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

①写出装置A 中发生反应的离子方程式_____________________________________________。
②装置F中试剂的作用是_______________;
用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为_______________。
③实验步骤:如图连接装置后,先__________________(填实验操作),再装药品,先点燃_____(填“ A” 或“C” )处酒精灯。
④写出装置G 中发生反应的离子方程式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中有臭氧(O3)生成.下列说法正确的是( )
A.O2和O3互为同位素
B.O2转化为O3为化学变化
C.相同物质的量的O2和O3的体积相同
D.相同质量的O2和O3含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是( )
A.Na+、Ba2+、Cl-、SO42-B.Na+、CO32-、Cl-、K+
C.Mg2+、Ag+、NO3-、Cl-D.H+、Cl-、Na+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如表:
元素 | 相关信息 |
A | 原子核外L层电子数是K层的2倍 |
B | 其一种单质被称为地球生物的“保护伞” |
C | 元素的第一电离能是第3周期所有元素中最小的 |
D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第周期、第族;D的基态原子核外电子排布式是 .
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) , B、D的简单氢化物中稳定性较大的是 .
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为;该化合物属于晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 .
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=﹣566.0kJmol﹣1
D(s)+B2(g)═DB2(g)△H=﹣296.0kJmol﹣1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸试剂的物质的量浓度为18.4 mol/L
B.稀释该硫酸时应把水倒入硫酸中,边倒边搅拌
C.50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol
D.标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com