
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO (g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)下列各项能作为判断反应Ⅰ在2 L的密闭容器中达到化学平衡状态的依据的
是_______(填序号字母)。
A.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
B.2v(H2)(正) = v(CO)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
【知识点】考查平衡状态判断、平衡移动、平衡常数、反应速率计算、热化学方程式
【答案解析】(每空2分)
(1) ①Ⅰ(1分) ②< (1分) ③80% (1分) 250 ℃ (1分)
(2) C (1分)
(3)CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-442.8 kJ·mol-(3分)
解析:(1)①产物更加集中,更加符合“原子经济”性。②升高温度,反应平衡常数减少,说明向逆反应方向进行,所以逆反应方向为为吸热反应,正反应方向为放热反应ΔH<0,③达到平衡后,测得c(CO)=0.2mol/L,则参加反应的CO的物质的量=2mol-0.2mol/L×2L=1.6mol,故CO转化率=1.6mol/2mol×100%=80%,
对于可逆反应:CO(g)+2H2(g)⇌CH3OH(g)
开始(mol/L):1 3 0
变化(mol/L):0.8 1.6 0.8
平衡(mol/L):0.2 1.4 0.8
所以该温度下平衡常数k=0.8/0.2*1.42=2.041,平衡常数只受温度影响,故该温度为250℃
(2)A、浓度之比不能作为反应平衡的判据,故A错误,B、任意时刻两者的速率关系均为2v(H2)(正) = v(CO)(逆),故B错误,C、该反应反应前后压强变化,当压强不变时,反应达到平衡状态,故C正确,D、反应前后质量与体积均不变,故密度不变,所以,密度不能作为反应平衡的判据,故D错误,所以正确答案为C。
(3)根据盖斯定律,①-②+③×4得2CH3OH(l)+2O2(g)=2CO(g)+4 H2O(l),该反应的反应热△H=-1275.6kJ•mol-1-(-566.0kJ•mol-1)+4×(-44.0kJ/mol)=-887kJ•mol-1
故该反应热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-442.8kJ•mol-1
【思路点拨】本题考查平衡状态判断、平衡移动、平衡常数、反应速率计算、热化学方程式、原电池、化学平衡图象等,是化学反应速率与化学平衡的综合题目,难度不大,注重基础知识的考查,(3)中电极反应式的书写为难点、易错点,可以先写出较为简单的正极反应式,利用总反应式减去正极反应式即为负极反应式.


科目:高中化学 来源: 题型:
铁及其化合物在生产和生活中有着广泛的应用。
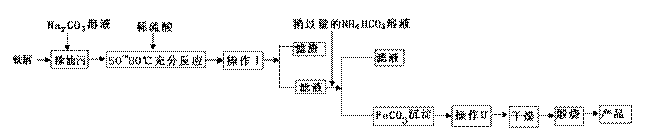
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
①操作Ⅰ、Ⅱ的名称分别是____ 、____。
②写出在空气中煅烧FeCO3的化学方程式 ;
③.煅烧如果不充分,产品中将有Fe2+ 存在,试设计实验检验产品中有无Fe2+ 。
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a. 称取2.850g绿矾(FeSO4·7H2O)产品,配成250mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①写出酸性KMnO4溶液与FeSO4 溶液反应的离子方程式
②计算上述样品中FeSO4·7H2O的质量分数为 [ 已知M(FeSO4·7H2O)=278g/mol]
③滴定达到终点时锥形瓶中溶液颜色变化为
④下列操作会导致样品中FeSO4·7H2O的质量分数的测定结果偏高的有_____________。
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定结束时仰视刻度线读数
d.量取待测液的滴定管没有润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
在指定的条件下,下列各组离子能大量共存的是( )
A.使甲基橙变红的溶液中:Fe2+、Na+、I-、NH4+
B.强碱性溶液中:K+、Na+、ClO-、S2-
C.0.1 mol·L-1 NaAlO2溶液中:H+、Na+、Cl-、SO42-
D.由H2O电离出的c(H+)=10-11mol/L溶液中:Na+、HCO3-、AlO2-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。下列有关双酚A的叙述不正确的是( )
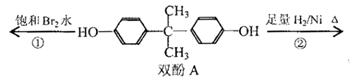
A.双酚A的分子式是C15H16O2
B.双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3
C.反应①中,1mol双酚A最多消耗2 mol Br2
D.反应②的产物中只有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,某些花岗岩会产生氡(22286Rn),这是一种放射性很强的原子,会对人体产生伤害,因此,家庭装修时应尽量避免使用天然产的花岗岩材料。已知氡是一种稀有气体元素,下列叙述正确的是( )
A.该原子与同周期ⅠA.ⅡA族阳离子具有相同的核外电子层结构
B.该原子最外层有8个电子 C.该原子中子数是86
D.1mol气体氡的质量大约是444g
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,CO和水蒸气各1mol放在密闭容器中反应:
CO(g) + H2O(g)  CO2(g) + H2(g)达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为 ( )
CO2(g) + H2(g)达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为 ( )
A.等于0.6mol B.等于1mol C.大于0.6mol小于1mol D.大于1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g) 2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
① 容器中气体的密度不再发生变化 ② X、Y、Z的浓度不再发生变化
③ 容器中的压强不再发生变化 ④ 单位时间内生成2n mol Z,同时消耗2n mol Y
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2> I->H2O2 >Fe2+>Cl-,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O==2Fe2++SO42-+4H+
B.I2+SO2+2H2O==H2SO4+2HI
C.H2O2+H2SO4==SO2↑+O2↑+2H2O
D.2Fe3++2I-== 2Fe2++I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com