
铁及其化合物在生产和生活中有着广泛的应用。
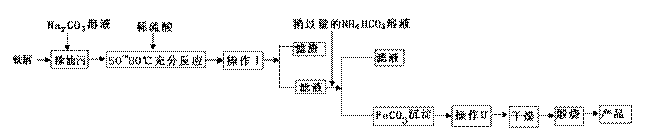
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:
①操作Ⅰ、Ⅱ的名称分别是____ 、____。
②写出在空气中煅烧FeCO3的化学方程式 ;
③.煅烧如果不充分,产品中将有Fe2+ 存在,试设计实验检验产品中有无Fe2+ 。
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a. 称取2.850g绿矾(FeSO4·7H2O)产品,配成250mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①写出酸性KMnO4溶液与FeSO4 溶液反应的离子方程式
②计算上述样品中FeSO4·7H2O的质量分数为 [ 已知M(FeSO4·7H2O)=278g/mol]
③滴定达到终点时锥形瓶中溶液颜色变化为
④下列操作会导致样品中FeSO4·7H2O的质量分数的测定结果偏高的有_____________。
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定结束时仰视刻度线读数
d.量取待测液的滴定管没有润洗
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中
Ca2+的含量(100 mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00 mL血液样品,处理后配制成50.00 mL溶液;
②准确量取溶液10.00 mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00 mL 0.0010 mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:
2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020 mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00 mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中c(Ca2+)≤1.0×10-5 mol·L-1,应保持溶液中c(C2O42-)≥ ▲ mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为 ▲ 。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将 ▲(填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量(写出计算过程)。
▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、C两种元素的原子核外电子数之和等于B的质子数,B原子核内质子数和中子数相等。据此填空:
| A | C | |
| B |
(1)A的氢化物分子式为 ,
(2)B在周期表中位于第 周期族;
(3)C的单质分子式为 ,C的单质溶于水所得溶液叫 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关物质的质量分数和物质的量浓度的叙述正确的是
A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡
沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1
B.Na 2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等
2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等
C.质量分数分别为5%和15%的氨水等体积混合后所得溶液的质量分数为10%
D.20℃时,饱和KCl溶液的密度为1.174g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数
为 ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全;另取一份加入含b mol HCl的盐酸恰好反应完全放出CO2,则该混合溶液中c(Na+)为:
A.(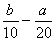 )mol/L B.(2b- a) mol/L C.(5b-
)mol/L B.(2b- a) mol/L C.(5b-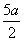 )mol/L D.(l0b - 5a) mol/L
)mol/L D.(l0b - 5a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色。下列说法正确的是( )
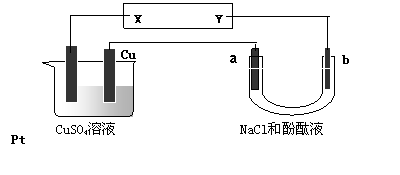
A.NaCl溶液浓度不变 B.X是负极,Y是正极
C.CuSO4溶液浓度变小 D.X是正极,Y是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应吸热
B.同温同压下,4Al(s)+3O2(g)===2Al2O3(s)在常温和点燃条件下的ΔH不同
C.稀溶液中:H+(aq)+OH—(aq) ===H2O(l);ΔH=—53.7KJ/mol ,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7KJ
D.由C(石墨)=== C(金刚石) △H= +1.90 kJ·mol-1 可知,金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO (g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)下列各项能作为判断反应Ⅰ在2 L的密闭容器中达到化学平衡状态的依据的
是_______(填序号字母)。
A.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
B.2v(H2)(正) = v(CO)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com