
【题目】著名化学家徐光宪在稀土领域贡献突出,被誉为“稀土界的袁隆平”。钇是稀土元素之一,我国蕴藏着丰富的钇矿石![]() ,工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
,工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
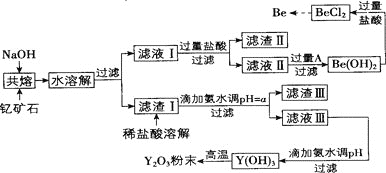
已知:
![]() 钇
钇![]() 的常见化合价为
的常见化合价为![]() 价;
价;
![]() 铍和铝处于元素周期表的对角线位置,化学性质相似;
铍和铝处于元素周期表的对角线位置,化学性质相似;
![]() 、
、![]() 形成氢氧化物沉淀时的pH如下表:
形成氢氧化物沉淀时的pH如下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2:1 | 3:1 |
Y3+ | 6.0 | 8.3 |
![]() 将钇矿石与NaOH共熔的反应方程式补充完整:
将钇矿石与NaOH共熔的反应方程式补充完整:
_____![]() _____
_____![]() _____
_____![]() _____
_____![]() _____
_____![]() _____
_____![]() _____
_____![]() _____
_____![]()
![]() 滤渣Ⅱ的主要成分是_________。
滤渣Ⅱ的主要成分是_________。
![]() 试剂A可以是_________
试剂A可以是_________![]() 填序号
填序号![]() 。
。
A NaOH溶液 ![]() 氨水
氨水 ![]()
![]()
![]() 用氨水调节
用氨水调节![]() 时,a的取值范围是_____________。
时,a的取值范围是_____________。
![]() 计算常温下
计算常温下![]() 的平衡常数
的平衡常数![]() ____________。
____________。![]() 常温下
常温下![]()
![]() 滤液Ⅲ加入氨水产生沉淀的离子方程式为___________。
滤液Ⅲ加入氨水产生沉淀的离子方程式为___________。
![]() 从
从![]() 溶液中得到
溶液中得到![]() 固体的操作是_______。
固体的操作是_______。
【答案】![]() 32
32 ![]() 8 2 8 8 4
8 2 8 8 4 ![]() 或
或![]()
![]()
![]()
![]()
![]()
![]() 蒸发结晶时,向溶液中持续通入HCl气体
蒸发结晶时,向溶液中持续通入HCl气体![]() 或在HCl气流中加热蒸干
或在HCl气流中加热蒸干![]()
【解析】
钇矿石与氢氧化钠共熔,加水溶解后可得到![]() 、
、![]() ,以及
,以及![]() 和
和![]() 沉淀,滤液Ⅰ加入过量盐酸,生成的滤渣Ⅱ为硅酸,滤液Ⅱ中含有
沉淀,滤液Ⅰ加入过量盐酸,生成的滤渣Ⅱ为硅酸,滤液Ⅱ中含有![]() ,可加入过量氨水生成
,可加入过量氨水生成![]() ,再加入盐酸生成
,再加入盐酸生成![]() ,蒸发结晶时,向溶液中持续通入HCl气体
,蒸发结晶时,向溶液中持续通入HCl气体![]() 或在HCl气流中加热蒸干
或在HCl气流中加热蒸干![]() ,经冷却结晶、洗涤、干燥后经冶炼可生成Be;过滤后得到的滤渣Ⅰ加入盐酸溶解,在此基础上加入氨水,由表中数据可知首先生成
,经冷却结晶、洗涤、干燥后经冶炼可生成Be;过滤后得到的滤渣Ⅰ加入盐酸溶解,在此基础上加入氨水,由表中数据可知首先生成![]() 沉淀,滤液Ⅲ加入过量氨水可生成
沉淀,滤液Ⅲ加入过量氨水可生成![]() ,煅烧可生成
,煅烧可生成![]() ,以此解答该题。
,以此解答该题。
根据上述分析可知:
![]() 将钇矿石与NaOH共熔的反应方程式为
将钇矿石与NaOH共熔的反应方程式为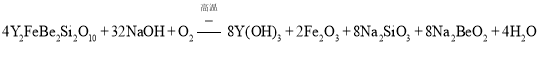 ;
;
故答案为:4;32;![]() ;8;2;8;8;4;
;8;2;8;8;4;
![]() 由以上分析可知滤渣Ⅱ的主要成分是
由以上分析可知滤渣Ⅱ的主要成分是![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
![]() 铍和铝处于元素周期表的对角线位置,化学性质相似,为避免
铍和铝处于元素周期表的对角线位置,化学性质相似,为避免![]() 溶解,应加入氨水;
溶解,应加入氨水;
故答案为:B;
![]() 用氨水调节
用氨水调节![]() 时,应全部除去铁离子,并避免生成
时,应全部除去铁离子,并避免生成![]() ,则a的取值范围是
,则a的取值范围是![]() ;
;
故答案为:![]() ;
;
![]() 常温下
常温下![]() 的平衡常数
的平衡常数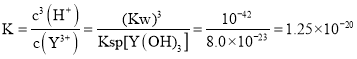 ;
;
故答案为:![]() ;
;
![]() 滤液Ⅲ加入氨水产生沉淀的离子方程式为
滤液Ⅲ加入氨水产生沉淀的离子方程式为![]() ;
;
故答案为:![]() ;
;
![]() 从
从![]() 溶液中得到
溶液中得到![]() 固体,应避免
固体,应避免![]() 水解,操作是蒸发结晶时,向溶液中持续通入HCl气体
水解,操作是蒸发结晶时,向溶液中持续通入HCl气体![]() 或在HCl气流中加热蒸干
或在HCl气流中加热蒸干![]() ;
;
故答案为:蒸发结晶时,向溶液中持续通入HCl气体![]() 或在HCl气流中加热蒸干
或在HCl气流中加热蒸干![]() 。
。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】煤气化是有效利用化石能源的手段之一,有关反应为
①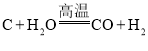 、②
、②![]() ,获得的气体称为水煤气。某研究性学习小组为探究气体的成分,进行了如下实验。
,获得的气体称为水煤气。某研究性学习小组为探究气体的成分,进行了如下实验。
(实验)使水蒸气通过灼热的焦炭,收集反应后流出的气体。
(提出假设)对气体的成分提出了三种假设。
假设1:该气体是![]() 、
、![]() 、
、![]() 。
。
假设2:该气体是![]() 、
、![]() 、
、![]() 。
。
(1)假设3:___________________________________________。
(设计实验方案,验证假设)
拟用图中提供的仪器,选择必要的试剂,设计一个实验,验证上述假设3。(加热装置和导管等在图中略去,实验前装置内部的空气已经排尽)
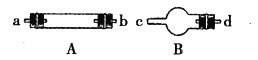
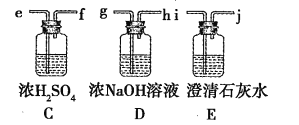
(2)按气流从左至右连接各仪器,用题中小写字母表示接口的连接顺序(仪器可重复使用):混合气→dc→______→______→______→______→______→ij。
(3)仪器A中需加入药品的名称是____________,其中反应的化学方程式可能有___________________________________________。
(4)仪器B中需加入药品的名称是______________,其作用是____________________________。
(思考与交流)
(5)本实验的尾气需要处理,处理的方法为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应为:Li+MnO2=LiMnO2,下列说法正确的是( )
A.锂是正极,电极反应为:Li-e-=Li+B.锂是负极,电极反应为:Li-e-=Li+
C.锂是负极,电极反应为:MnO2+e-=MnO![]() D.锂是负极,电极反应为:Li-2e-=Li2+
D.锂是负极,电极反应为:Li-2e-=Li2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成医用麻醉药苄佐卡因E和食品防腐剂J的路线如图所示:
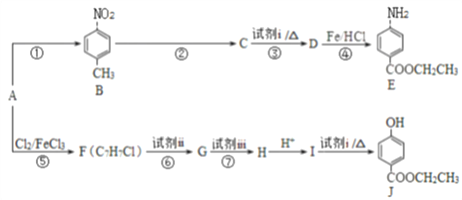
已知:
请回答下列问题:
(1)A属于芳香烃,结构简式为_____________。
(2)E中官能团的名称是氨基、____________。
(3)C能与NaHCO3溶液反应,反应③的化学方程式是___________。
(4)反应⑥、⑦中试剂ii和试剂iii依次是 ___________、___________。
(5)反应①~⑦中,属于取代反应的是_______________。
(6)J有多种同分异构体,其中符合下列条件的同分异构体有______________种,写出其中任一种同分异构体的结构简式:___________。
a. 为苯的二元取代物,其中一个取代基为羟基
b. 属于酯类,且能发生银镜反应
(7)以A为起始原料,选用必要的无机试剂合成高分子树脂(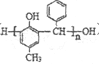 ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_______________。
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣![]() 主要成分为ZnO,还含有铁、铝、铜的氧化物,
主要成分为ZnO,还含有铁、铝、铜的氧化物,![]() 、
、![]() 、
、![]() 等
等![]() 制取氧化锌的工艺流程如图所示:
制取氧化锌的工艺流程如图所示:
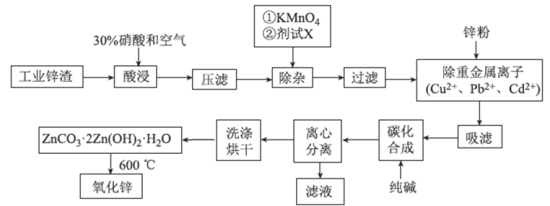
已知:相关金属离子![]() 生成氢氧化物沉淀的pH如下表所示:
生成氢氧化物沉淀的pH如下表所示:
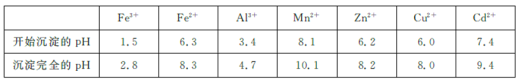
回答下列问题:
![]() 为调节溶液的pH,则试剂X为_________
为调节溶液的pH,则试剂X为_________![]() 填化学式
填化学式![]() ,
,
![]() 除杂时加入高锰酸钾的作用是_________,发生反应的离子方程式为___________。
除杂时加入高锰酸钾的作用是_________,发生反应的离子方程式为___________。
![]() “过滤”所得滤渣的主要成分是_________
“过滤”所得滤渣的主要成分是_________![]() 填化学式
填化学式![]() 。
。
![]() 写出“碳化合成”的化学方程式:________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________。
写出“碳化合成”的化学方程式:________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物结构为: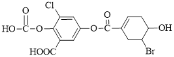 ,下列说法中正确的是
,下列说法中正确的是
A.该物质的化学式为C15H8O8BrCl
B.该物质能与FeCl3 溶液发生显色反应
C.1 mol 该物质最多能与 2 mol 溴水发生反应
D.一定条件下,1 mol 该物质最多能与 9 mol NaOH 反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 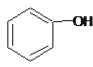 和
和 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
B. ![]() 和
和 ![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香族化合物
既是芳香烃又是芳香族化合物
C. 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式一定为C2H5-OH
D. 分子式为C4H8的有机物可能存在4个C—C单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是( )
C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是( )

A. 反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B. 反应体系中加入催化剂,反应速率增大,△H增大
C. △H < 0,反应达到平衡时,升高温度,A的转化率减少
D. △H > 0,反应达到平衡时,增大压强,A的转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲苯合成苯甲醛(苯甲醛),下列说法正确的是( )
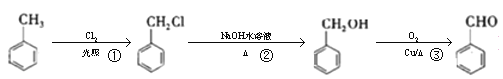
A.![]() 可以作为萃取剂萃取溴水中的溴单质
可以作为萃取剂萃取溴水中的溴单质
B.反应①②③的反应类型相同
C. 的同分异构体有3种
的同分异构体有3种
D. 和
和![]() 可以通过酸性高锰酸钾鉴别
可以通过酸性高锰酸钾鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com