
【题目】常温下,用 0.1000 mol·L-1NaOH 溶液滴定 20.00 mL 0.1000 mol·L-1的 CH3COOH 溶液所得滴定曲线如图。下列说法正确的是
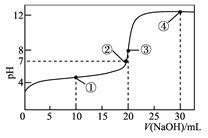
A. 点①所示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-)
B. 点②所示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
C. 点③所示溶液中:c(H+)=c(CH3COOH)+c(OH-)
D. 点④所示溶液中:2c(OH-)-2c(H+)=c(CH3COO-)+3c(CH3COOH)
【答案】AD
【解析】A.点①反应掉一半醋酸,反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),由电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故A正确;B.点②pH=7,即c(H+)=c(OH-),由电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可知:c(Na+)=c(CH3COO-),故B错误;C.点③说明两溶液恰好完全反应生成CH3COONa,溶液中存在质子守恒式为c(OH-)=c(CH3COOH)+c(H+),故C错误;D.完全反应后点④所示溶液中c(CH3COONa)∶c(NaOH)=2:1,溶液中存在电荷守恒式为c(CH3COO-)+c(OH-)=c(Na+)+c(H+),物料守恒式为2c(Na+)=3c(CH3COOH)+3(CH3COO-),可知2c(OH-)-2c(H+)=c(CH3COO-)+3c(CH3COOH),故D正确;答案为AD。


科目:高中化学 来源: 题型:
【题目】(12分)A~G各物质间的关系如下图,其中B、D为气态单质。

请回答下列问题:
(1)物质C和E的名称分别为 、 ;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为 ;
若只能在加热情况下进行,则反应物A的化学式(分子式)为 ;
(3)反应②的化学方程式为 ;
(4)新配制的F溶液应加入 以防止其转化为G。检验G溶液中阳离子的常用试剂是 (填化学式),实验现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金。Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成[Cu(NH3)4]SO4深蓝色溶液。
(1)Cu基态原子核外电子排布式为________________。
(2)1 mol Ni(CO)4中含有σ键的数目为_______________。
(3)[Cu(NH3)4]SO4中阴离子的空间构型是___________,与SO42-互为等电子体的分子为_______________。(填化学式)
(4) NH3的沸点_______________。(选填“高于”或“低于”)PH3,原因是_______________。
(5)某白铜合金晶胞结构如右图所示.晶胞中铜原子与镍原子的个数比为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol L-1 | 0.10 | 0.20 | 0.20 |
C(SO2)/ mol L-1 | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反应在前2 min的平均速率v(SO2)=0.05 mol L-1 min-1
B. 达到平衡时,容器丙中正反应速率与容器甲相等
C. 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0
D. 容器乙中若起始时改充0.10 molL-1 NO2和0.20molL-1 SO2,达到平衡时c(NO)与原平衡相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是:
A. 纤维素在人体内不能水解成葡萄糖,不能作为人类的营养物质,但可以帮助人消化
B. 二氧化硫能杀灭霉菌和细菌,可用作食物和干果的防腐剂
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 生吃新鲜蔬菜比熟吃蔬菜更有利于获取维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第______周期第_______族。
(2)E元素形成的氧化物对应的水化物的化学式为______。
(3)元素B、C、D、E形成的简单离子半径大小关系是_________。(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:_________。
(5)由A、B、C三种元素形成的离子化合物的化学式为_________,它与强碱溶液共热,发生反应的离子方程式是_________。
(6) D2EC3一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为
_________。(化学式用具体的元素符号表示)。
(7)E的某种氧化物是大气污染物之一,也是某工业生产中的主要尾气之一。某校兴趣小组欲采用下列方案测定此工业尾气中的E的氧化物的含量。
 通过的尾气体积为VL(已换算成标准状况)时,该尾气中E的氧化物含量(体积分数)为_______(用含有V、m的代数式表示).
通过的尾气体积为VL(已换算成标准状况)时,该尾气中E的氧化物含量(体积分数)为_______(用含有V、m的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素。下列说法不正确的是

A. 原子半径:Y>X B. 最高价氧化物的水化物的酸性:R>W
C. 气态氢化物的稳定性:X>W D. 单质与水(或酸)反应的剧烈程度:Z>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com