
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第______周期第_______族。
(2)E元素形成的氧化物对应的水化物的化学式为______。
(3)元素B、C、D、E形成的简单离子半径大小关系是_________。(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:_________。
(5)由A、B、C三种元素形成的离子化合物的化学式为_________,它与强碱溶液共热,发生反应的离子方程式是_________。
(6) D2EC3一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为
_________。(化学式用具体的元素符号表示)。
(7)E的某种氧化物是大气污染物之一,也是某工业生产中的主要尾气之一。某校兴趣小组欲采用下列方案测定此工业尾气中的E的氧化物的含量。
 通过的尾气体积为VL(已换算成标准状况)时,该尾气中E的氧化物含量(体积分数)为_______(用含有V、m的代数式表示).
通过的尾气体积为VL(已换算成标准状况)时,该尾气中E的氧化物含量(体积分数)为_______(用含有V、m的代数式表示).
【答案】 二 VA H2SO3 H2SO4 S2- N3- O2- Na+ 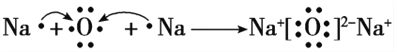 NH4NO3 NH4++OH-
NH4NO3 NH4++OH-![]() NH3↑+H2O 4Na2SO3=Na2S+3Na2SO4 22.4m/233V
NH3↑+H2O 4Na2SO3=Na2S+3Na2SO4 22.4m/233V
【解析】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,则A为H元素;B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,B元素的原子半径是其所在主族中最小的,应为N元素;C元素原子的最外层电子数比次外层多4个,只能有2个电子层,最外层电子数为6,应为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,D为Na元素;C、E主族,则E为S元素。即A是氢元素,B是氮元素,C是氧元素,D钠元素,E是硫元素。
(1)B是氮,在周期表中的位置为第二周期第ⅤA族。(2)E元素是硫,形成的氧化物SO2、SO3对应的水化物的化学式为 H2SO3 、H2SO4 ;(3)元素B、C、D、E形成的简单离子S2― 有三个电子层,N3- O2- Na+ 只有两处电子层,且电子层结构相同,核电荷大的半径反而小,半径大小关系是S2- N3- O2- Na+ ;(4)用电子式表示化合物D2C即Na2O的形成过程,Na最外层一个电子易失去,氧最外层6个电子,易得到2个电子形成稳定结构,![]() ,(5)由A、B、C三种元素即H、N、O形成的离子化合物的化学式为NH4NO3 它是铵盐,与强碱溶液共热,发生反应生成NH3,离子方程式是NH4++OH-
,(5)由A、B、C三种元素即H、N、O形成的离子化合物的化学式为NH4NO3 它是铵盐,与强碱溶液共热,发生反应生成NH3,离子方程式是NH4++OH-![]() NH3↑+H2O ;(6) D2EC3即Na2SO3一定条件下可以发生分解反应生成两种盐,其中一种是无氧酸盐,是Na2S,化学方程式4Na2SO3=Na2S+3Na2SO4 ;(7)mg是硫酸钡的质量,硫酸钡的物质的量为 mg/233g·mol-1 = m/233 mol,根据硫元素守恒可知二氧化硫的体积为 m/233 mol×22.4L·mol-1= 22.4m/233 L,故尾气中二氧化硫的体积分数 22.4m/233 L/VL = 22.4m/233V ;
NH3↑+H2O ;(6) D2EC3即Na2SO3一定条件下可以发生分解反应生成两种盐,其中一种是无氧酸盐,是Na2S,化学方程式4Na2SO3=Na2S+3Na2SO4 ;(7)mg是硫酸钡的质量,硫酸钡的物质的量为 mg/233g·mol-1 = m/233 mol,根据硫元素守恒可知二氧化硫的体积为 m/233 mol×22.4L·mol-1= 22.4m/233 L,故尾气中二氧化硫的体积分数 22.4m/233 L/VL = 22.4m/233V ;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】气体X和气体Y通入液体Z的洗气瓶中(如图),一定没有沉淀生成的是( )
X | Y | Z |
| |
A | NO2 | SO2 | BaCl2 | |
B | NH3 | Cl2 | Fe2(SO4)3 | |
C | NH3 | CO2 | NaCl | |
D | CO2 | SO2 | CaCl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L-1NaOH 溶液滴定 20.00 mL 0.1000 mol·L-1的 CH3COOH 溶液所得滴定曲线如图。下列说法正确的是
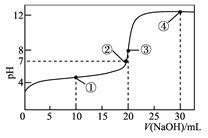
A. 点①所示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-)
B. 点②所示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
C. 点③所示溶液中:c(H+)=c(CH3COOH)+c(OH-)
D. 点④所示溶液中:2c(OH-)-2c(H+)=c(CH3COO-)+3c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ.为确认该溶液组成进行如下实验:①取20.0mL该溶液,加入25.0mL 4.00molL-1NaOH溶液,有白色沉淀、无剌激气味气体生成.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100mL,测得滤液中c(OHˉ)为0.20molL-1;②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g.由此可得出关于原溶液组成的正确结论是
A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+
B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+
C.c(Clˉ)为 4.00molL-1,c(Al3+)为1.00 molL-1
D.c(Mg2+)为 1.00molL-1,c(Na+)为 0.50 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学史上每一次重大发现都极大的推进了科学的发展,俄国科学家门捷列夫对化学的突出贡献在于( )
A.提出了元素周期律
B.开发了合成氨的生产工艺
C.揭示了燃烧的本质
D.提取了治疟药物青蒿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于粗盐提纯的下列说法正确的是 ( )
A. 溶解粗盐时,应多加水尽量使溶液稀些,防止食盐溶解不完全
B. 滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩
C. 当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干
D. 将制得的晶体转移到新制过滤器中用大量水进行洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.沿海城市建筑时直接从海洋里取用海沙,可以大大降低成本
B.“地沟油”禁止使用,但处理后可以制生物柴油和肥皂
C.乙醇溶液、双氧水均可用于杀菌消毒,但原理不同
D.维生素C和铁粉是常用的抗氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(17分)亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。
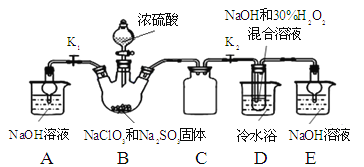
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要 (填仪器名称);
(2)装置C的作用是 ;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为 。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是 ;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作iii。
i.55℃蒸发结晶;
ii.趁热过滤;
iii. ;
iv.低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是 ;
a. B中有SO2气体产生,并有部分进入D装置内
b. B中浓硫酸挥发进入D中与NaOH中和
c. B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是 ;
②所称取的样品中NaClO2的物质的量为 (用含c、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com