
工业上常利用CO和H2合成可再生能源甲醇。
(1)已知CO(g)、CH3OH(l)的燃烧热分别为283.0 kJ·mol-1和726.5 kJ·mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)合成甲醇的方程式为CO(g)+2H2(g) CH3OH(g) ΔH <0。
CH3OH(g) ΔH <0。
在230 ℃〜270 ℃最为有利。为研究合成气最合适的起始组成比n(H2):n(CO),分别在230 ℃、250 ℃和270 ℃进行实验,结果如下左图所示。其中270 ℃的实验结果所对应的曲线是_____(填字母);当曲线X、Y、Z对应的投料比达到相同的CO平衡转化率时,对应的反应温度与投较比的关系是 。
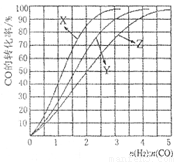
(3)当投料比为1∶1,温度为230 ℃,平衡混合气体中,CH3OH的物质的量分数为 (保留1位小数);平衡时CO的转化率 。
(1)CH3OH (l) + O2(g) = CO(g) + 2H2O(l) ΔH=-443.5 kJ·mol-1
(2) Z 投料比越高,对应的反应温度越高 (3)33.3% 40%
【解析】
试题分析:(1)CO(g)燃烧的热化学方程式为CO(g)+1/2 O2(g)= CO2(g) ΔH=
—283.0 kJ/mol ; ① CH3OH(l) 燃烧的热化学方程式为CH3OH(l) +3/2 O2(g)= CO2(g)+
+ 2H2O(l) ΔH= —726.5 kJ/mol; ②. ②-①整理可得:CH3OH (l)
+ O2(g) = CO(g) + 2H2O(l) ΔH=-443.5 kJ/mol.(2) 合成甲醇的方程式为CO(g)+2H2(g)
 CH3OH(g)
ΔH <0。由于该反应的正反应为放热反应,所以当反应达到平衡后,当n(H2)/n(CO)不变时,升高温度,化学平衡吸热反应 (即逆反应) 方向移动,CO的转化率降低,甲醇的产率也减小。因此这三个曲线中Z对应的是270 ℃的实验结果。这对合成甲醇的产率来说不利。但是温度过低,虽然产率高了,但反应速率太低,达到平衡所需要的时间太长,效率也不高。因此综上所述常采用在230 ℃〜270 ℃最为有利。根据平衡移动原理,在其它条件不变时,增加某种反应物的浓度,能使平衡正向移动,使其它反应物的转化率提高,而其本身的转化率降低。当曲线X、Y、Z对应的投料比达到相同的CO平衡转化率时,对应的反应温度与投较比的关系是投料比越高,对应的反应温度越高。(3)n(H2)/n(CO)=1:1,假设n(H2)= n(CO)=1mol,有图像可知在230 ℃,当反应达到平衡时CO的转化率为40%,,根据反应的方程式CO(g)+2H2(g)
CH3OH(g)
ΔH <0。由于该反应的正反应为放热反应,所以当反应达到平衡后,当n(H2)/n(CO)不变时,升高温度,化学平衡吸热反应 (即逆反应) 方向移动,CO的转化率降低,甲醇的产率也减小。因此这三个曲线中Z对应的是270 ℃的实验结果。这对合成甲醇的产率来说不利。但是温度过低,虽然产率高了,但反应速率太低,达到平衡所需要的时间太长,效率也不高。因此综上所述常采用在230 ℃〜270 ℃最为有利。根据平衡移动原理,在其它条件不变时,增加某种反应物的浓度,能使平衡正向移动,使其它反应物的转化率提高,而其本身的转化率降低。当曲线X、Y、Z对应的投料比达到相同的CO平衡转化率时,对应的反应温度与投较比的关系是投料比越高,对应的反应温度越高。(3)n(H2)/n(CO)=1:1,假设n(H2)= n(CO)=1mol,有图像可知在230 ℃,当反应达到平衡时CO的转化率为40%,,根据反应的方程式CO(g)+2H2(g) CH3OH(g)可知:此时n(CO)=0.6mol, n(H2)=0.2mol,n(CH3OH) =0.4mol, 在平衡混合气体中,CH3OH的物质的量分数为:0.4mol÷(0.6mol+0.2mol+0.4mol)×100%=
33.3%.
CH3OH(g)可知:此时n(CO)=0.6mol, n(H2)=0.2mol,n(CH3OH) =0.4mol, 在平衡混合气体中,CH3OH的物质的量分数为:0.4mol÷(0.6mol+0.2mol+0.4mol)×100%=
33.3%.
考点:考查热化学方程式的书写、温度、浓度对化学平衡的影响及物质的含量、转化率的计算的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
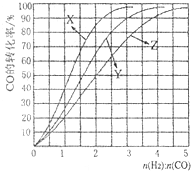 工业上常利用CO和H2合成可再生能源甲醇.
工业上常利用CO和H2合成可再生能源甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源:2014届江西省景德镇市高三一检化学试卷(解析版) 题型:填空题
Ⅰ.恒温,容积为1
L恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g)  2SO3(g)
ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g)
ΔH=-196.6 kJ·mol-1),请回答下列问题:
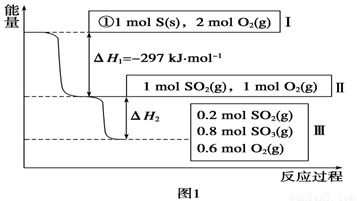
(1)写出能表示硫的燃烧热的热化学方程式:______________________。
(2)ΔH2=__________kJ·mol-1。
Ⅱ.工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l)
 CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
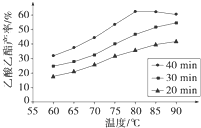
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118 ℃、78 ℃和77 ℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
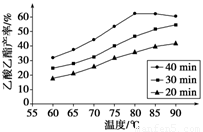
(1)该研究小组的实验目的是___________________________________。
(2)60 ℃下反应40 min与70 ℃下反应20 min相比,前者的平均反应速率________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40 min、温度超过80 ℃时,乙酸乙酯产率下降的原因可能是_________________________________(写出两条)。
Ⅲ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
试回答下列问题:
(1)在800 ℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填“A、B、C、D、E”)。
n(CO) n(H2O) n(H2) n(CO2)
A 1 5 2 3
B 2 2 1 1
C 3 3 0 0
D 0.5 2 1 1
E 3 1 2 1
(2)已知在一定温度下,C(s)+CO2(g)  2CO(g)平衡常数为K;
2CO(g)平衡常数为K;
①C(s)+H2O(g)  CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2(g) 平衡常数为K1;
②CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数为K2;
H2(g)+CO2(g) 平衡常数为K2;
则K、K1、K2之间的关系是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com