
����Ŀ�����ǹ��ɿ������ʯ����Ҫ�ɷ֣����ʹ輰�仯������й㷺����;�����������գ�
I.ijЩ�����ξ���ɸѡ���ӵĹ��ܣ�һ�ֹ����ε����Ϊ��M2O��R2O3��2SiO2��nH2O����֪Ԫ��M��R��λ��Ԫ�����ڱ��ĵ�3���ڡ���Ԫ��ԭ�ӵ�������֮��Ϊ24��
��1���ù�������ͬ����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ________________��
��2��д��Mԭ�Ӻ���������ߵĵ��ӵĵ����Ų�ʽ��__________________��
��3�������£�������R���ʷ�����Ӧ����___________��ѡ����ţ���
a��CuCl2��Һ b��Fe2O3 c��Ũ���� d��Na2CO3��Һ
��4��д��M��R����Ԫ�ص�����������Ӧ��ˮ���ﷴӦ�����ӷ���ʽ��____________________________________________��
II.�����裨Si3N4���մɲ���Ӳ�ȴ��۵�ߡ��������з�Ӧ�Ƶã�SiO2+C+N2![]() Si3N4+CO
Si3N4+CO
��5��Si3N4������ֻ�м��Թ��ۼ�����ԭ�ӵĻ��ϼ�Ϊ______������ԭ��Ԫ��Ϊ______________��
��6��C3N4�Ľṹ��Si3N4���ơ���Ƚ϶����۵�ߵ͡���˵�����ɣ�_____________________��
��7����ƽ������Ӧ�Ļ�ѧ����ʽ�����������ת�Ƶ���Ŀ�ͷ���_________________
��8�����������Ӧ��10L���ܱ������н��У�һ��ʱ����������ܶ�������2.8g/L�����Ƶõ�Si3N4����Ϊ_____________��
���𰸡�Na >Al>Si 3s1 bd ![]() -3 N2�е�Ԫ�� ���߾�Ϊԭ�Ӿ��壬̼ԭ�Ӱ뾶С�ڹ�ԭ�Ӱ뾶�����C3N4��̼ԭ���뵪ԭ���γɵĹ��ۼ�������Si3N4�й�ԭ���뵪ԭ���γɵĹ��ۼ�����С�����ܽϴ��۵�ϸ�
-3 N2�е�Ԫ�� ���߾�Ϊԭ�Ӿ��壬̼ԭ�Ӱ뾶С�ڹ�ԭ�Ӱ뾶�����C3N4��̼ԭ���뵪ԭ���γɵĹ��ۼ�������Si3N4�й�ԭ���뵪ԭ���γɵĹ��ۼ�����С�����ܽϴ��۵�ϸ�  35g
35g
��������
I����1��������Ļ��ϼ۴�����Ϊ0�����M��+1�ۣ�R��+3�ۣ�M��R��λ��Ԫ�����ڱ��ĵ�3���ڣ���Ԫ��ԭ�ӵ�������֮��Ϊ24����MΪNa��RΪAl���ù�������Na��Al��SiΪͬ����Ԫ�أ�Ԫ������Խ����뾶ԽС����˰뾶��С��ϵΪ��Na >Al>Si��
��2��Mԭ�Ӻ���������ߵĵ���λ�ڵ����ܲ㣬�����ܲ���ֻ��1�����ӣ�������Ų�ʽΪ��3s1��
��3�������£�Al��CuCl2��Һ��Ӧ�ܽ�ͭ�û�������Al��Fe2O3�ڸ��·�Ӧ��Al��Ũ���ᷢ���ۻ���Al��Na2CO3��Һ�ڳ����²�������Ӧ��
�ʴ�Ϊ��bd��
��4��Na��Al����Ԫ�ص�����������Ӧ��ˮ����ֱ�Ϊ��NaOH��Al(OH)3�����߷�Ӧ�����ӷ���ʽΪ��![]() ��
��
II����5���ǽ�����N>Si�����Si3N4��NԪ�ػ��ϼ�Ϊ-3�ۣ��÷�Ӧ��NԪ�ػ��ϼ۴�0�۽�����-3�ۣ�NԪ�ر���ԭ��
��6��Si3N4�մɲ���Ӳ�ȴ��۵�ߣ�������ֻ�м��Թ��ۼ���˵��Si3N4Ϊԭ�Ӿ��壬C3N4�Ľṹ��Si3N4���ƣ�˵��C3N4Ϊԭ�Ӿ��壬���߾�Ϊԭ�Ӿ��壬̼ԭ�Ӱ뾶С�ڹ�ԭ�Ӱ뾶�����C3N4��̼ԭ���뵪ԭ���γɵĹ��ۼ�������Si3N4�й�ԭ���뵪ԭ���γɵĹ��ۼ�����С�����ܽϴ��۵�ϸߣ�
��7���÷�Ӧ��SiԪ�ػ��ϼ۲��䣬NԪ�ػ��ϼ۴�0�۽�����-3�ۣ�CԪ�ػ��ϼ۴�0��������+2�ۣ����ݵ�ʧ���ӹ�ϵ�Լ�ԭ���غ���ƽ����ʽ�Լ�������Ϊ�� ��
��
��8�������ܶ�������2.8g/L��˵����������������2.8g/L ��10L=28g��
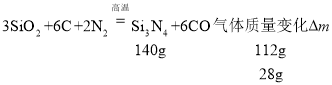
������ɵ�Si3N4����Ϊ![]() =35g��
=35g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
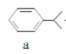
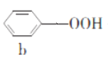
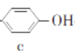
����Ŀ�����Ӻͱ�ͪ������Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ���������������������Ӻͱ�ͪ���䷴Ӧ��������ʾ��ͼ���£������й�˵����ȷ����
![]()
![]()
 +
+![]()
A.a��b��c�����ڷ�����B.a��d������̼ԭ�Ӿ�����ͬһƽ����
C.A��9�����ڷ������ͬ���칹��D.c��d���ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��������ʵ�������ijͬѧ����AΪ��Ҫԭ�Ϻϳ�������������ϳ�·������ͼ��ʾ����ش�
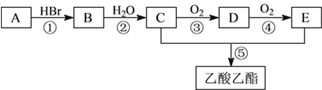
��1��C�����й����ŵĵ���ʽ��_______________��C��ͬ���칹��F�ĺ˴Ź��������У�ֻ��һ��������ԭ�ӵ����շ壬F�Ľṹ��ʽ��___________��
��2����Ӧ�ڵĻ�ѧ����ʽ��__________________________________����Ӧ�ݵĻ�ѧ����ʽ��__________________________________��
��3��Ϊ�˼���B�е���Ԫ�أ����²���������˳����_______________������ţ���
a����AgNO3��Һ b����NaOH ��Һ c������ d����ϡ��������Һ������
��4��ʵ������A�Ļ�ѧ����ʽ��__________________________________�����Ʊ��в���SO2�����A������֤��д��SO2����ˮ��Ӧ�����ӷ���ʽ��__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ϵͼ�����з�����ȷ����

A. �÷�Ӧ�����ȷ�Ӧ
B. ����a����ЧӦ��
C. �÷�Ӧ���Ȼ�ѧ����ʽΪ��4HCl + O2 �� 2Cl2 +2H2O + 115.6 kJ
D. ����Ӧ����2molҺ̬ˮ���ų�����������115.6kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E 5��Ԫ�أ����ǵĺ˵�������������Ҷ�С��20������C��E�ǽ���Ԫ�أ�A��E��ͬһ�壬����ԭ�ӵ����������Ų�Ϊns1��B��DҲ��ͬһ�壬����ԭ��������p�ܼ���������s�ܼ���������������Cԭ��������ϵ���������Dԭ��������ϵ�������һ�롣��ش��������⣺
(1)A��________��B��________��E��_________��
(2) д��CԪ�ػ�̬ԭ�ӵĵ����Ų�ʽ_________________________��
(3)д��DԪ��ԭ�ӵļ۵����Ų�ͼ____________________��
(4) Ԫ��B��D�ĵ縺�ԵĴ�С��ϵ��___________��C��E�ĵ�һ�����ܵĴ�С��ϵ��___________��(����>������<������=��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ(CuCl)�������й㷺����������ɱ��������ɫ����ij��ȤС����ü��ȷֽ��Ȼ�ͭ����(CuCl2��xH2O)�ķ����Ʊ�CuCl����װ������(�г�����ʡ��)��

��֪��

���������գ�
(1)��ʵ������У����Թ۲쵽C����ֽ����ɫ�仯��___________________________��
(2)ʵ���������Ҫȫ��ͨ������HCl����������___________________________��
(3)��Ӧ������ȡ��CuCl��Ʒ����ʵ�飬�������к������������ʣ�������֪��Ϣ
�� ��������CuCl2���������ԭ�������____________________________________��
�� ��������CuO���������ԭ�������_____________________________________��
(4)Ϊ�ⶨԭ��CuCl2��xH2O�нᾧˮ����Ŀx���ɲ�ȡ���·�����
a���õ�����ƽ��ȡһ�������Ȼ�ͭ���� b����______(����������)�г������
c���ڸ���������ȴ d���������ú�ɫ��������
e���ظ�b ~ d����ֱ��_____________________
�� �������ʵ��������衣
�� ���Ȼ�ͭ��������Ϊ3.384 g�����յõ���ɫ��������Ϊ1.600 g����x =________(��ȷ��0.1)��
�� �����������������ղⶨ�����������Ϊ1.5%��д�����ܵ��¸ý����һ�������____________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪ![]() ������˵����ȷ����
������˵����ȷ����
A. 1L0.1mol��![]() NH4Cl��Һ�У�
NH4Cl��Һ�У� ![]() ������Ϊ0.1
������Ϊ0.1![]()
B. 2.4gMg��H2SO4��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.1![]()
C. ��״���£�2.24LN2��O2�Ļ�������з�����Ϊ0.2![]()
D. 0.1mol H2��0.1mol I2���ܱ������г�ַ�Ӧ�����������Ϊ0.2![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ���ѻ��ɵõ��л���(CH3)2C=C(CH3)2(������A��ʾ)��
��1��A��ϵͳ����Ϊ________��A��ͨ��״���³�________(����������Һ����������)̬��
��2��A��Br2�ļӳɲ���B��NaOH���Ҵ���Һ���ȿ����ɶ�ϩ��C����C�Ľṹ��ʽΪ___________________��B����C�ķ�Ӧ����Ϊ________��
��3��C��һ����Br2��Ӧ��������D��E��G����D��HBr�ļӳɲ���ֻ��F����D�γɸ߷��ӻ�����Ļ�ѧ����ʽΪ__________________________________________��
��4��C��ͬ���칹���в�����Ϊ________(����ĸ)
a.������ b.Ȳ�� c.��ϩ�� d.��ϩ��
��C��һ��ͬ���칹��H��KMnO4������Һ���ɼ����ᣬ��H�Ľṹ��ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��ʯ���ѽ�������Ҫ�ɷ֣����IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ����ش��������⡣
��1����ϩ�ķ���ʽ___���ṹ��ʽ___��
��2������������ϩ���Լ���___(�����)��
A.ϡ���� B.������Ȼ�̼��Һ C.ˮ D.���Ը��������Һ
��3�����������У�����ͨ����ϩ�ӳɷ�Ӧ�õ�����___(�����)��
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
��4����֪�Ҵ��ܺ�������ͭ�Ĵ������·�Ӧ������ȩ��CH3CHO��H2O����2CH3CHO+O2![]() 2CH3COOH��������ϩΪ��Ҫԭ�Ϻϳ����ᣬ��ϳ�·����ͼ��ʾ��
2CH3COOH��������ϩΪ��Ҫԭ�Ϻϳ����ᣬ��ϳ�·����ͼ��ʾ��
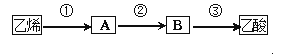
��Ӧ�ٵĻ�ѧ����ʽΪ___����ҵ������ϩΪԭ�Ͽ�������һ����Ҫ�ĺϳ��л��߷��ӻ�����䷴Ӧ�Ļ�ѧ����ʽΪ__����Ӧ������___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com