
【题目】根据能量关系图,下列分析正确的是

A. 该反应是吸热反应
B. 曲线a的热效应大
C. 该反应的热化学方程式为:4HCl + O2 → 2Cl2 +2H2O + 115.6 kJ
D. 若反应生成2mol液态水,放出的热量高于115.6kJ
【答案】D
【解析】
A、根据图像,反应物的能量比生成物能量高,所以该反应为放热反应,故A错误;
B、依据图像,反应物的能量比生成物能量高,所以该反应为放热反应,△H=生成物总能量 -反应物总能量,与反应的途径无关,曲线a、b的热效应相同,故B错误;
C、热化学方程式中需要注明物质的状态,△H=生成物总能量 -反应物总能量,则反应的热化学方程式为:4HCl(g)+O2(g)→2Cl2+2H2O(g)+115.6kJ,故C错误;
D、该反应的热化学方程式为:4HCl(g)+O2(g)→2Cl2+2H2O(g)+115.6kJ,又气态水变成液态水还要放热,所以若反应生成2mol液态水,放出的热量高于115.6kJ,故D正确;
答案选D。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】用![]() 表示阿佛加德罗常数,下列说法正确的是( )
表示阿佛加德罗常数,下列说法正确的是( )
A.常温常压下,11.2 L氧气含有的原子数为![]() 个
个
B.标准状况下,0.2 mol ![]() 的体积为4.48 L
的体积为4.48 L
C.2.3 g金属钠变为离子失去电子数为![]() 个
个
D.常温常压下,![]() 个氢分子的质量为2 g
个氢分子的质量为2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。

(1)除如图装置所示的实验用品外,还需要的一件实验用品是______________。
(2)圆底烧瓶中所发生反应的离子方程式为___________。
(3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(4)利用该化学反应,试简述测定反应速率的其他方法:________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2 Na2S2O3=== Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(5)表中Vx=__________mL,T1、T2、T3的大小关系是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ,其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g) ,其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为__________反应(填“吸热”或“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是______________(多选扣分).
A.容器中压强不变 B.混合气体中 c(CO)不变
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(3)850℃ 时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2
和xmolH2,则:
当x=5.0时,上述平衡向____________(填“正反应”、“逆反应”、“恰好平衡”)方向进行.
② 若要使上述反应开始时向正反应方向进行,则x应满足的条件是_________________.
(4)在850℃时,若设x=5.0mol和x=6.0mol,其他物质的投料不变,当上述反应达到平衡后,
测得H2的体积分数分别为a%、b% ,则a _________ b (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W是药物合成的中间体,它的一种合成路线如下:

回答下列问题:
(1)试剂a是___________。
(2)A的名称是___________;F中官能团的名称是___________。
(3)下列说法正确的是___________(填正确选项编号)。
a.CH2= CHCHO不存在顺反异构体 b.D能发生水解反应
c.E的分子式为C9H14NO2 d.⑧发生了还原反应
(4)反应③的化学方程式是___________。
(5)G(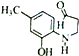 )有多种同分异构体。属于丁酸酯且苯环上含一NH2的同分异构体有___________种,其中核磁共振氢谱显示为6组峰,且峰面积之比为3:2:2:2:2:2的结构简式为___________。
)有多种同分异构体。属于丁酸酯且苯环上含一NH2的同分异构体有___________种,其中核磁共振氢谱显示为6组峰,且峰面积之比为3:2:2:2:2:2的结构简式为___________。
(6)  是制药中间体,结合题中流程和已学知识设计由D为起始原料合成
是制药中间体,结合题中流程和已学知识设计由D为起始原料合成 的合成路线图:___________(无机试剂任选)。
的合成路线图:___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是我国化工专家侯德榜发明的联合制碱法简要流程:

关于此流程说法正确的是
A. 副产品Y是NH4HCO3B. 向母液中通入的气体X是CO2
C. 循环II是为了提高食盐的利用率D. 析出NaHCO3后的母液中只含NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—种新型可逆电池的工作原理如图所示,放电时总反应为Al+3Cn(AlCl4)+4AlCl4-![]() Al2Cl7-+3Cn- (Cn代表石墨),下列说法正确的是
Al2Cl7-+3Cn- (Cn代表石墨),下列说法正确的是

A. 充电时,石墨电极作阴极
B. 充电时,熔融盐中的A1C14-向右移动
C. 放电时,负极反应为:2A1 - 6e-+ 7C1-= A12C17-
D. 放电时,若电路中转移3 mol电子,则有1 mol Cn(A1C14)被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
【答案】D
【解析】试题分析:A.相同浓度的氨水与盐酸,氨水实际上还会促进水的电离,所以由水电离产生的c(H+):①>③,B.如果③是强碱的话,稀释100倍,其pH一定为11,但是关键氨水是弱碱,无论稀释到什么程度,都会有未电离的氨水存在,所以pH一定比11要小。C.①与③混合得到的是氯化铵,氯化铵是强酸弱碱盐,显酸性,所以若想要其pH为7,则氨水的用量一定要比盐酸的用量大才可以。D.所得溶液显碱性,所以氢氧根离子的浓度一定要比氢离子的浓度大,而且铵根离子的浓度要比氯离子的浓度大。
考点:考查了弱电解质的电离平衡、盐类水解、离子浓度的大小比较的相关知识。
【题型】单选题
【结束】
18
【题目】25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子树脂具有较好的吸水性,其合成线路如下:

已知:I:-CHO+-CH2CHO![]() -CH=CHCHO
-CH=CHCHO
II. -CH=CH-COOH
-CH=CH-COOH
回答下列问题
(1)G中的含氧官能团名称为______,M的结构简式为_______。
(2)由A生成B的化学方程式为______________________。
(3)上述合成路线中,D→E的转化在合成M中的作用为_________________。
(4)下列选项中对有机物F的性质推测正确的是_______________________。(填字母)
A. 1mol F与足量NaHCO3溶液反应放出2molCO2
B. 能发生水解反应和消去反应
C. 能聚合成高分子化合物
D. 1 mol F最多消耗3 mol NaOH
(5)符合下列条件的G的同分异构体有________种
A.属于芳香族化合物,且只有1种官能团
B.能发生银镜反应
C.除苯环外不存在其他环状结构
其中核磁共振氢谐有4组峰的是________(写出其中一种的结构简式)
(6)根据上述合成路线和信息,以苯乙醛为原料(其他无机试剂任选)设计制备 的合成路线______
的合成路线______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com