
【题目】草酸(H2C2O4)是一种二元弱酸,在菠菜、苋菜、甜菜等植物中含量较高。25℃时,向H2C2O4溶液中滴加NaOH溶液,混合溶液中lgX[X表示c(HC2O4-)/c(H2C2O4)或c(C2O42-)/c(HC2O4-)]随pH的变化关系如图所示。下列说法不正确的是

A. 直线I中X表示的是c(HC2O4-)/c(H2C2O4)
B. 直线I、Ⅱ的斜率均为1
C. 0.1mol/ L NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 已知:碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11,则向Na2CO3溶液中加入等物质的量的草酸溶液的离子方程式为CO32-+H2C2O4===C2O42-+H2O+CO2↑
【答案】C
【解析】
二元弱酸的电离平衡常数![]() ,直线I表示的X与c(H+)的乘积等于1×10-1.22,则H2C2O4的Ka1=1×10-1.22;直线Ⅱ表示X与c(H+)的乘积等于1×10-4.19,则H2C2O4的Ka2=1×10-4.19。
,直线I表示的X与c(H+)的乘积等于1×10-1.22,则H2C2O4的Ka1=1×10-1.22;直线Ⅱ表示X与c(H+)的乘积等于1×10-4.19,则H2C2O4的Ka2=1×10-4.19。
A. 直线I表示的X与c(H+)的乘积等于1×10-1.22,所以直线I中X表示的是c(HC2O4-)/c(H2C2O4),故A正确;
B、直线I表示的X与c(H+)的乘积等于1×10-1.22,lgx=pH-1.22;直线Ⅱ表示X与c(H+)的乘积等于1×10-4.19,lgx=pH-4.19,所以直线I、Ⅱ的斜率均为1,故B正确;
C、HC2O4-的电离平衡常数=1×10-4.19,HC2O4-的水解平衡常数=![]() ,电离大于水解,溶液显酸性,所以0.1mol/ L NaHO2O4溶液中:c(Na+)>c(HC2O4-) >c(C2O42-) >c(H2C2O4),故C错误;
,电离大于水解,溶液显酸性,所以0.1mol/ L NaHO2O4溶液中:c(Na+)>c(HC2O4-) >c(C2O42-) >c(H2C2O4),故C错误;
D、H2C2O4的Ka2大于碳酸的Ka1,所以向Na2CO3溶液中加入等物质的量的草酸溶液,生成草酸钠和二氧化碳,离子方程式为CO32-+H2C2O4===C2O42-+H2O+CO2↑,故D正确;选C。


 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
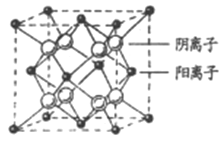
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为铜锌原电池示意图,下列说法中不正确的是( )

A.锌为负极,铜为正极
B.电子由锌片通过导线流向铜片
C.锌片质量逐渐减少,铜片质量逐渐增加
D.该装置能把化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A. 密闭容器中混合气体的密度不变
B. 2v(NH3)正=v(CO2)逆
C. 密闭容器中c(NH3)∶c(CO2)=2∶1
D. 密闭容器中c(NH3)和c(CO2)浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 14g由N2和13C2H2组成的混合物中,所含中子数为7NA
B. CH4与白磷(P4)都为正四面体结构,则1 mol CH4与1molP4所含共价键的数目均为4NA
C. 反应N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
2NH3(g) △H=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
D. 含0.5 mol NH4NO3与 r mol NH3·H2O的中性溶液中,含有NH4+的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象和用途中,浓硫酸表现脱水性的是( )
A.实验室制取氯气时浓硫酸做干燥剂
B.浓硫酸使火柴梗变黑
C.浓硫酸滴到胆矾上,蓝色晶体变成白色粉末
D.浓硫酸与碳单质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
① H2(g) + ![]() O2(g) = H2O(
O2(g) = H2O(![]() );△H = -285kJ/mol
);△H = -285kJ/mol
② H2O(g) = H2(g) + ![]() O2(g); △H = + 241.8kJ/mol
O2(g); △H = + 241.8kJ/mol
③ C(s) + ![]() O2(g) = CO(g); △H = -110.4kJ/mol
O2(g) = CO(g); △H = -110.4kJ/mol
④ C(s) + O2(g) = CO2(g);△H = -393.5kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是______________。(用序号填写)
(2)燃烧10g H2生成液态水,放出的热量为_____________。
(3)CO的燃烧热的热化学方程式为___________________________________。
(4)已知常温下拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为:___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.28g聚乙烯中含有NA个碳碳双键
B.1mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气的分子数最多为6NA
C.标准状况下,2.24LCCl4中的原子总数等于0.5NA
D.15g甲基含有的电子数是9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验事实的解释错误的是
选项 | 实验事实 | 解释 |
A | 用容量瓶配制一定浓度的溶液,定容时仰视读数使所配溶液浓度偏低 | 溶液凹液面最低处高于刻度线 |
B | 用标准硝酸银溶液滴定溶液中氯离子时,标准液盛放在棕色滴定管中 | 硝酸银见光分解 |
C | 向10mL 0.5mol/L的氯化镁溶液中滴加5mL 2.4mol/L氢氧化钠溶液,产生白色沉淀再滴加氯化铜溶液,沉淀变蓝 | Ksp[Cu(OH)2 ]<Ksp[Mg(OH)2 ] |
D | 长时间存放的漂白粉的试剂瓶可用稀盐酸清洗 | 漂白粉在空气中转化为碳酸钙能溶于盐酸 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com