
【题目】为了探究影响化学反应速率的因素,现设计如图所示两组对比试验:

(1)第1组:实验目的是探究________对化学反应速率的影响。
(2)第2组:甲中电流表指针偏转程度更大,说明反应物浓度越大,化学反应速率_____(“越大”“越小”)
(3)第2组甲中,当放出2.24L(标准状况)气体时,理论上消耗的锌的质量是____ g;
(4)甲烷-氧气燃料电池的工作原理如图所示:

①该电池工作时,a处(左侧)通入的物质为_______,b处(右侧)通入的物质为_____。
②该电池负极的电极反应式为________________。
③工作一段时间后,当12.8 g甲烷完全反应时,发生电子转移数目为____________。
【答案】 温度 越大 6.5g CH4 O2 CH4-8e-+2H2O=CO2+8H+ 6.4NA
【解析】试题分析:
(1)第1组实验的变量是温度。
(2)电流表指针偏转程度越大,化学反应速率越大;
(3)第2组甲中,发生的总反应是Zn+2H+=Zn2++H2↑,根据方程式计算放出2.24L(标准状况)气体时,理论上消耗的锌的质量;
(4)甲烷-氧气燃料电池中甲烷失电子发生氧化反应,氧气得电子发生还原反应:
①根据工作原理图,电子由电极c流向电极d,c是负极、d是正极。
②甲烷在负极失电子发生氧化反应。
③根据负极反应式计算12.8 g甲烷完全反应时,电子转移数目。
解析:(1)第1组实验的变量是温度,所以第1组实验目的是探究温度对化学反应速率的影响。
(2)电流表指针偏转程度越大,化学反应速率越大,甲硫酸浓度大,说明反应物浓度越大,化学反应速率;
(3)设消耗锌的质量为xg,
![]()
![]() x=6.5g
x=6.5g
(4)甲烷-氧气燃料电池中甲烷失电子发生氧化反应,氧气得电子发生还原反应:
①根据工作原理图,电子由电极c流向电极d,c是负极、d是正极。所以该电池工作时,a处通入的物质为CH4,b处通入的物质为O2;
②甲烷在负极失电子发生氧化反应,电极反应为CH4-8e-+2H2O=CO2+8H+。
③设12.8 g甲烷完全反应时,电子转移数目为x
![]()
![]() ,x=6.4NA
,x=6.4NA


科目:高中化学 来源: 题型:
【题目】电影《闪闪的红星》中,为让被困的红军战士吃上食盐,潘冬子将浸透食盐水的棉袄裹在身上,带进山中.假如潘冬子在实验室中,欲从食盐水中提取出食盐,采用的最好方法是( )
A.过滤 B.蒸发 C.萃取 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+四种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:
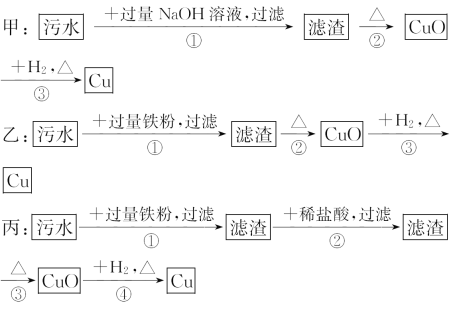
下列判断正确的是( )
A.三种实验方案中都能制得纯净的铜
B.乙方案中加过量铁粉可以将四种阳离子全部还原
C.甲方案中的反应涉及置换、分解、化合、复分解四种反应类型
D.丙方案会产生环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属晶体和离子晶体是重要晶体类型。下列关于它们的说法中正确的是
A. 金属晶体和离子晶体都能导电
B. 在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用
C. 金属晶体和离子晶体都可采取紧密堆积方式
D. 金属晶体和离子晶体中分别存在金属键和离子键等强烈的相互作用,很难断裂,因而都具有延展性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作或测量数据的说法正确的是
A. 用托盘天平称量食盐的质量为12.35克
B. 用碱式滴定管量取高锰酸钾溶液20.00mL
C. 用pH试纸测量氢氧化钠稀溶液的pH为11.5
D. 中和热的测定实验中,NaOH溶液应该稍过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是
A. 氯化棚液态时能导电而固态时不导电 B. 氯化硼中心原子采用sp杂化
C. 氯化硼分子呈平面三角形,属非极性分子 D. 其分子立体构型类似NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com