
【题目】下列有关实验操作或测量数据的说法正确的是
A. 用托盘天平称量食盐的质量为12.35克
B. 用碱式滴定管量取高锰酸钾溶液20.00mL
C. 用pH试纸测量氢氧化钠稀溶液的pH为11.5
D. 中和热的测定实验中,NaOH溶液应该稍过量
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】(Ⅰ)沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。难溶物在水中溶解达到饱和时,即建立沉淀溶解平衡,平衡常数称为溶度积(Ksp)。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)将浓度均为0.1mol/L的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=________mol/L。取100mL滤液与100mL2mol/LNa2SO4的溶液混合,混合液中c(Ba2+)= ______mol/L。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4 转化为CaCO3的离子方程式为___________________
②请分析CaSO4 转化为CaCO3的原理____________________
(Ⅱ)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为_________________。
(2)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=________________,联氨和N2O4可作为火箭推进剂的主要原因为________________________。
(Ⅲ)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。

(1)滴定
①用 _____式滴定管盛装0.1000 mol/L盐酸标准液,锥形瓶中装有25.00mL待测烧碱溶液。上图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入②表空格中。
②有关数据记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
滴定前 | 滴定后 | 消耗的体积 | ||
1 | 25.00 | 0.50 | 25.95 | 25.45 |
2 | 25.00 | _______ | _______ | ______ |
3 | 25.00 | 6.00 | 31.55 | 25.55 |
(2)根据所给数据,计算出烧碱样品的物质的量浓度。c = _________________。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ________ ;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果__________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是( )
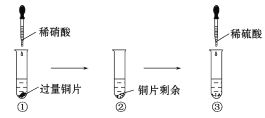
A.实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B.实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C.实验③发生反应的化学方程式为3Cu+Cu(NO3)2+4H2SO44CuSO4+2NO↑+4H2O
D.由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究影响化学反应速率的因素,现设计如图所示两组对比试验:

(1)第1组:实验目的是探究________对化学反应速率的影响。
(2)第2组:甲中电流表指针偏转程度更大,说明反应物浓度越大,化学反应速率_____(“越大”“越小”)
(3)第2组甲中,当放出2.24L(标准状况)气体时,理论上消耗的锌的质量是____ g;
(4)甲烷-氧气燃料电池的工作原理如图所示:

①该电池工作时,a处(左侧)通入的物质为_______,b处(右侧)通入的物质为_____。
②该电池负极的电极反应式为________________。
③工作一段时间后,当12.8 g甲烷完全反应时,发生电子转移数目为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学生利用左图装置测定反应过程中所放出的热量并计算中和热。请回答问题:
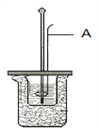
图中A仪器名称为__________。烧杯间填满碎纸条的作用是____________。
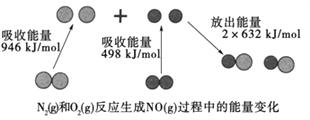
Ⅱ.右图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化示意图,
试判断1mol N2(g)和1mol O2(g)具有的总能量__________2mol NO(g)具有的总能量。(“大于”或“小于”)
Ⅲ.有如下两个反应:A、2HCl+Ba(OH)2= BaCl2+2H2O;B、2Fe3++Cu= 2Fe2++Cu2+
(1)根据两反应的本质,判断能设计成原电池的是:__________(填“A”或“B” )。
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池:
①负极材料是_________,电解质溶液是__________;
②写出负极的电极反应式______________;
③原电池工作时溶液中的Cl-向_________极移动(填”正”或”负”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
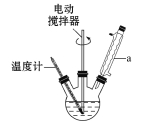
【题目】苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理、有关数据及装置示意图如下:
![]()
![]()
![]()
![]()
![]()
名称 | 性状 | 熔点/℃ | 沸点/℃ | 密度 /g·cm-3 | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.866 9 | 不溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 112.4 (100℃左右升华) | 248 | 1.265 9 | 微溶 | 易溶 |
苯甲酸在水中的溶解度如表中所示:
温度/℃ | 4 | 18 | 75 |
溶解度/g | 0.2 | 0.3 | 2.2 |
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
一、制备苯甲酸
在三颈烧瓶中加入2.7 mL甲苯、100 mL水和2~3片碎瓷片,开动电动搅拌器,a中通入流动水,在石棉网上加热至沸腾,然后分批加入8.5 g高锰酸钾,继续搅拌约4~5 h,直到甲苯层几乎近于消失、回流液不再出现油珠,停止加热和搅拌,静置。
二、分离提纯
在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,苯甲酸全部析出后减压过滤,将沉淀物用少量冷水洗涤,挤压去水分后放在沸水浴上干燥,得到粗产品。
三、测定纯度
称取mg产品,配成100 mL乙醇溶液,移取25.00 mL溶液于锥形瓶中,滴加2~3滴酚酞,然后用标准浓度KOH溶液滴定。
请回答下列问题:
(1)装置a的名称是________,其作用为_________________________________。
(2)甲苯被高锰酸钾氧化的原理为![]() +KMnO4
+KMnO4![]() +MnO2↓+H2O+ ________,请完成并配平该化学方程式。
+MnO2↓+H2O+ ________,请完成并配平该化学方程式。
(3)分离提纯过程中加入的草酸是一种二元弱酸,反应过程中有酸式盐和无色气体生成。加入草酸的作用是_______________________,请用离子方程式表示反应原理:__________________。
(4)产品减压过滤时用冷水洗涤的原因是_______________________________。
(5)选用下列________(选填字母)操作,可以将粗产品进一步提纯。
A.溶于水后过滤 B.溶于乙醇后蒸馏
C.用甲苯萃取后分液 D.升华
(6)测定纯度步骤中,滴定终点溶液的颜色变化是_________________________。
若m=1.200 g,滴定时用去0.120 0 mol·L-1标准KOH溶液20.00 mL,则所得产品中苯甲酸的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图甲装置电解一定量的CuSO4溶液,M、N为惰性电极.电解过程实验数据如图乙所示.X轴表示电解过程中转移电子的物质的量,Y轴表示电解过程产生气体的总体积。则下列说法不正确的是( )
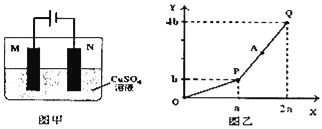
A. A点所得溶液只需加入一定量的CuO固体就可恢复到起始状态
B. 电解过程中N电极表面先有红色物质生成,后有气泡产生
C. Q点时M、N两电极上产生的气体总量在相同条件下体积相同
D. 若M电极材料换成Cu做电极,则电解过程中CuSO4溶液的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国南朝(梁)陶弘景著《本草经集注》中记叙药物730种,其中“消石”条目下写道:“…如握雪不冰.强烧之,紫青烟起,仍成灰…”.这里的“消石”是指( )
A.氯化钠
B.硝酸按
C.高锰酸钾
D.硝酸钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com