
【题目】I.某学生利用左图装置测定反应过程中所放出的热量并计算中和热。请回答问题:
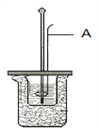
图中A仪器名称为__________。烧杯间填满碎纸条的作用是____________。
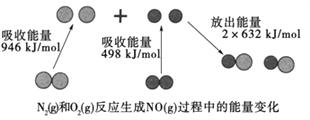
Ⅱ.右图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化示意图,
试判断1mol N2(g)和1mol O2(g)具有的总能量__________2mol NO(g)具有的总能量。(“大于”或“小于”)
Ⅲ.有如下两个反应:A、2HCl+Ba(OH)2= BaCl2+2H2O;B、2Fe3++Cu= 2Fe2++Cu2+
(1)根据两反应的本质,判断能设计成原电池的是:__________(填“A”或“B” )。
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池:
①负极材料是_________,电解质溶液是__________;
②写出负极的电极反应式______________;
③原电池工作时溶液中的Cl-向_________极移动(填”正”或”负”)。
【答案】 环形玻璃搅拌棒 减少实验过程中的热量损失 小于 B Cu FeCl3 溶液 Cu-2e- =Cu2+ 负
【解析】试题分析:I.图中A仪器是环形玻璃搅拌棒 。碎纸条能隔热。
Ⅱ.反应物的总键能-生成物的总键能=焓变,根据焓变判断反应物、生成物能量的大小;
Ⅲ.有如下两个反应:A、2HCl+Ba(OH)2= BaCl2+2H2O;B、2Fe3++Cu= 2Fe2++Cu2+
(1)氧化还原反应能设计成原电池。
(2)原电池中负极发生氧化反应,电解质发生还原反应;电解池中阴离子移向负极。
解析:I. 量热器A仪器是环形玻璃搅拌棒 。碎纸条能隔热,烧杯间填满碎纸条的作用是减少实验过程中的热量损失;Ⅱ.N2(g)+O2(g)=2NO(g),△H=946+498-632×2=180KJ/mol,反应放热,1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量;
Ⅲ.有如下两个反应:A、2HCl+Ba(OH)2= BaCl2+2H2O;B、2Fe3++Cu= 2Fe2++Cu2+
(1)2Fe3++Cu= 2Fe2++Cu2+属于氧化还原反应,有电子转移,2Fe3++Cu= 2Fe2++Cu2+能设计成原电池。
(2)反应2Fe3++Cu= 2Fe2++Cu2+中,铜失电子发生氧化反应,Fe3+得电子发生还原反应,①负极材料是Cu,电解质溶液是FeCl3 溶液;②写出负极的电极反应式Cu-2e- =Cu2+;③电解池中阴离子移向负极,Cl-向负极移动。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列与实验相关的叙述错误的是( )
A.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的![]() ,液体也不能蒸干
,液体也不能蒸干
B.给试管中的液体加热时要不时移动试管,以免暴沸
C.可用稀硝酸鉴别MgI2、AgNO3、Na2CO3、NaAlO2四种溶液
D.稀释浓硫酸时,如果戴有防护眼罩,可以把水慢慢倒入装有浓硫酸的烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以黄铜矿(主要成分CuFeS2)为原料进行如下实验探究,为测定黄铜矿中硫元素的质量分数,将m1g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品。

(1)锥形瓶A内所盛试剂是________溶液;装置B的作用是________________;
锥形瓶D内发生反应的离子方程式为__________________________________。
(2)反应结束后将锥形瓶D中的溶液进行如下处理:

如图则向锥形瓶D中加入过量H2O2溶液反应的离子方程式为________________;
操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法_________________________;
该黄铜矿中硫元素的质量分数为________(用含m1、m2的代数式表示)。
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是________。
A.KSCN溶液、氯水
B.稀盐酸、KMnO4溶液
C.稀硫酸、KMnO4溶液
D.NaOH溶液
(4)已知:Cu+在强酸性环境中会发生反应生成Cu和Cu2+,设计实验方案验证泡铜中是否含有Cu2O?
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作或测量数据的说法正确的是
A. 用托盘天平称量食盐的质量为12.35克
B. 用碱式滴定管量取高锰酸钾溶液20.00mL
C. 用pH试纸测量氢氧化钠稀溶液的pH为11.5
D. 中和热的测定实验中,NaOH溶液应该稍过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y和Z均为短周期主族元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)Y元素的名称为________。Z的离子结构示意图为_________。
元素Y的简单离子和元素Z的简单离子,半径较大的是________(写出离子符号)。
(2)X和Y组成的化合物中,既含极性共价键又含非极性共价键的是______(写化学式),该物质核外电子总数为______。
(3)化合物Z2Y2的电子式为___________。
(4)X的单质与Y的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表,下列说法错误的是( )
物质 | X | Y | Z | W |
初始浓度/molL﹣1 | 0.5 | 0.6 | 0 | 0 |
平衡浓度/molL﹣1 | 0.1 | 0.1 | 0.4 | 0.6 |
A. 反应达到平衡时,X的转化率为80%
B. 该反应的平衡常数表达式为k=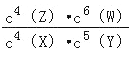
C. 增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,1mol的任何气体所占的体积都约为22.4L,其主要原因是
A.气体分子间的距离较大,且在标准状况下气体分子间平均距离几乎相等
B.不同气体的分子大小几乎相等
C.标准状况下不同气体的密度几乎相等
D.标准状况下相同质量的气体其分子数几乎相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广。
(1)制备硅半导体材料必须先得到高纯硅,工业上可以按如下步骤制备高纯硅。
Ⅰ.高温下用碳还原二氧化硅制得粗硅;
Ⅱ.粗硅与干燥的氯气在450~500 ℃条件下反应制得SiCl4;
Ⅲ.SiCl4液体经精馏提纯后与过量H2在1 100~1 200 ℃条件下反应制得高纯硅。
已知SiCl4沸点为57.6 ℃,能与H2O强烈反应。
请回答下列问题:
①第Ⅲ步反应的化学方程式为____________________________________。
②整个制备纯硅的过程中必须严格控制在无水无氧的条件下。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是_______;H2还原SiCl4过程中若混入O2,可能引起的后果是________________________________________。
(2)二氧化硅被大量用于生产玻璃。工业上用SiO2、Na2CO3和CaCO3共283 kg在高温下完全反应时放出CO2 44 kg,生产出的玻璃可用化学式Na2SiO3·CaSiO3·xSiO2表示,则其中x=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com