
【题目】X、Y和Z均为短周期主族元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)Y元素的名称为________。Z的离子结构示意图为_________。
元素Y的简单离子和元素Z的简单离子,半径较大的是________(写出离子符号)。
(2)X和Y组成的化合物中,既含极性共价键又含非极性共价键的是______(写化学式),该物质核外电子总数为______。
(3)化合物Z2Y2的电子式为___________。
(4)X的单质与Y的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极电极反应式为_________。
【答案】 氧 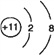 O2- H2O2 18
O2- H2O2 18 ![]() 2H2O +O2 +4e- =4OH-
2H2O +O2 +4e- =4OH-
【解析】试题分析: X的单质为密度最小的气体,X是H元素;Y原子最外层电子数是其周期数的三倍,Y是O元素;Z与X原子最外层电子数相同,Z是Na元素。
解析:根据以上分析,(1)Y元素的名称为氧。Z是Na元素,Na+结构示意图为![]() 。
。
O2-与Na+电子层数相同,O原子序数小于Na,所以O2-半径较大。
(2)H和O组成的化合物是H2O、H2O2,既含极性共价键又含非极性共价键的是H2O2, H2O2核外电子总数为18。
(3)化合物Na2O2的电子式为![]() ;
;
(4)氢氧燃料电池(KOH溶液作电解质溶液),负极通入氢气,正极通入氧气发生还原反应,正极电极反应式为2H2O +O2 +4e- =4OH-。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O
C. 盐酸滴在石灰石上:CO32-+2H+=CO2↑+H2O
D. 盐酸与饱和的澄清石灰水反应:H++OH﹣═H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,含A元素的有关微粒物质的量变化如下图所示。根据图示判断,下列说法正确的是

A. H2A在水中的电离方程式是:H2A== H++HA-;HA-![]() H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C. 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+ c(HA-)+ 2c(H2A)=c(A2-)+2c(OH-)
D. 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是 。
(2)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是 。(填序号)
①NaAlO2②Ca(OH)2③Na2CO3④Al(OH)3⑤NaHCO3⑥Si
(3)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是 ;过一会儿,溶液颜色逐渐褪去,起作用的成分是 ;
(4)已知:Fe2+的还原性强于Br—,标准状况下把11.2L氯气通入500ml 0.8mol/L FeBr2溶液中,写出反应完全后的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学生利用左图装置测定反应过程中所放出的热量并计算中和热。请回答问题:
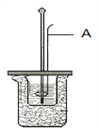
图中A仪器名称为__________。烧杯间填满碎纸条的作用是____________。
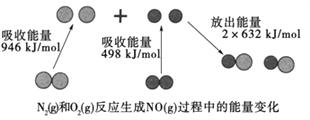
Ⅱ.右图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化示意图,
试判断1mol N2(g)和1mol O2(g)具有的总能量__________2mol NO(g)具有的总能量。(“大于”或“小于”)
Ⅲ.有如下两个反应:A、2HCl+Ba(OH)2= BaCl2+2H2O;B、2Fe3++Cu= 2Fe2++Cu2+
(1)根据两反应的本质,判断能设计成原电池的是:__________(填“A”或“B” )。
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池:
①负极材料是_________,电解质溶液是__________;
②写出负极的电极反应式______________;
③原电池工作时溶液中的Cl-向_________极移动(填”正”或”负”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为::2CH3OH+3O2+4KOH=2K2CO3+6H2O。下列说法正确的是
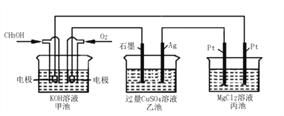
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 金属钠加入滴有酚酞的水中,溶液变红:Na+2H2O=Na++2OH-+H2↑
B. 用NaOH溶液吸收单质碘:I2+6OH-=5I-+IO3-+3H2O
C. 将NaHCO3溶液和过量Ca(OH)2溶液混合有白色沉淀:2HCO3-+Ca2++2OH-=CaCO3↓+ 2H2O + CO32-
D. 二氧化锰和浓盐酸反应:MnO2+4HCl![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应N2O4(g) ![]() 2NO2(g)(△H>0)在密闭容器中达到平衡.下列说法不正确的是
2NO2(g)(△H>0)在密闭容器中达到平衡.下列说法不正确的是
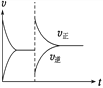
A. 加压时(体积变小),平衡向逆反应方向移动,将使正反应速率增大
B. 某时刻改变条件速率时间如右图,改变的条件是恒容时增大N2O4的浓度
C. 保持体积不变,加入少许N2O4,平衡向正反应方向移动,再达平衡时颜色变深
D. 保持压强不变,加入少许N2O4,混合气体的相对平均分子质量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com