
【题目】明矾石经处理后得到明矾( KAl(SO4)2·12H2O)。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
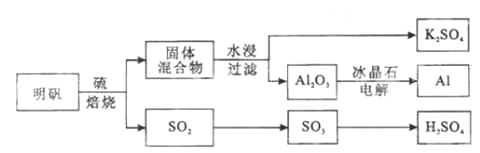
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________。
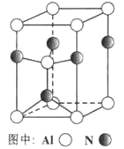
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)![]() 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
【答案】S 蒸发结晶 4 Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2 SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ·mol-1 432
【解析】
(1)4KAl(SO4)212H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价。硫酸根离子中硫元素化合价从+6价变化为+4价,故还原剂是硫单质,而氧化剂是6mol的硫酸根离子,即3mol的4KAl(SO4)212H2O,故答案为:S;
(2)从溶液中得到固体硫酸钾,可以才用蒸发结晶的方法,故答案:蒸发结晶;
(3)由图可知一个铝与4个氮原子成键,所以晶体中Al的杂化轨道方式为sp3,依据晶体晶胞结构分析,结合配位数含义可知,每个氮原子和四个铝原子相连,所以氮原子的配位数为4,故答案为:4;
(4)①以Al和NiO(OH)为电极,铝做原电池 负极失电子发生氧化反应,电极反应式为:Al-3e-+4OH-=AlO2-+2H2O;正极NiO(OH)得到电子发生还原反应,所以阳极反应为:Ni(OH)2-e-+OH-=NiO(OH)+H2O,故答案为:Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2;
(5)2SO2(g)+O2(g)2SO3(g)△H1=-197kJ/mol; ①
2H2O(g)=2H2O(1)△H2=-44kJ/mol; ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ/mol. ③
依据盖斯定律③-①-②得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-304KJ/mol,
即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-152KJ/mol;
948 t明矾生成SO2物质的量为4500mol 故生成硫酸的质量m=4500×0.96×98÷0.98=432000Kg=432t.
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ/mol;432.


科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于3 区域的( )

A.Cl2+2KBr = Br2+2KCl
B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O =4Fe(OH)3
D.2Na2O2+2H2O =4NaOH+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)![]() 2Fe2O3(s)常温下可自发进行,该反应为吸热反应
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种具有重要用途的气体,在工业上大量用于制造盐酸、有机溶剂和杀菌消毒剂等。甲同学在实验室进行氯气性质的研究。
(1)甲同学依次进行了Cl2与①钠、②铜、③氢气、④水反应的实验。
上述反应中属于氧化还原反应的是___(填序号)。
(2)写出铁丝在氯气中燃烧的化学方程式:___。
(3)H2 +Cl2![]() 2HCl,用单线桥或双线桥表示电子转移的方向和数目:___。发生还原反应的物质是___。
2HCl,用单线桥或双线桥表示电子转移的方向和数目:___。发生还原反应的物质是___。
(4)甲同学探究氯气能否与水发生反应

①B中纸条褪色,结合化学方程式解释原因___。
②装置A的作用是___。
③烧杯中发生反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气(NH3)是一种重要的化工原料,广泛应用于制氮肥、制药、合成纤维等。请回答下列问题:
(1)2molNH3在标准状况下的体积是___。
(2)2molNH3的质量是___,其中所含氢元素的质量是___。
(3)2molNH3所含的氨分子数为___,电子数为___。
(4)工业上用反应N2+3H2 ![]() 2NH3来合成氨气,则若制得2molNH3,标准状况下参与反应的H2的体积为___;14克N2参与反应可得NH3物质的量为___。
2NH3来合成氨气,则若制得2molNH3,标准状况下参与反应的H2的体积为___;14克N2参与反应可得NH3物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B. 铜溶于稀硝酸:3Cu+ 8H+ +2NO3—=3Cu2+ +2NO↑ + 4H2O
C. 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
D. 稀硫酸中滴加氢氧化钡溶液:H++ OH—=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积不变的密闭容器中进行如下反应:N2(g)+3H2(g)![]() 2NH3(g),达到平衡。下列说法不正确的是( )
2NH3(g),达到平衡。下列说法不正确的是( )
A. 其它条件不变,缩小容器体积,平衡正向移动,K值变大
B. 其它条件不变,通入少量氦气,平衡不移动
C. N2、H2、NH3百分含量不再变化
D. 其它条件不变,升高温度,化学平衡一定发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等离子。下列叙述中正确的是( )

A. A膜是阳离子交换膜
B. 通电后,海水中阴离子往b电极处移动
C. 通电后,b电极上产生无色气体,溶液中出现白色沉淀
D. 通电后,a电极的电极反应式为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去粗盐中的杂质CaCl2、MgCl2和Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是( )
A. 除去Mg2+的主要反应:MgCl2+2NaOH-=Mg(OH)2↓+2NaCl
B. 试剂①一定不是Na2CO3溶液
C. 检验SO42-是否除净:取少量滤液,加稀盐酸酸化,再加BaCl2溶液
D. 滤液加稀盐酸时只发生反应:HCl+NaOH=H2O+NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com