
【题目】能正确表示下列反应的离子方程式是
A. 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B. 铜溶于稀硝酸:3Cu+ 8H+ +2NO3—=3Cu2+ +2NO↑ + 4H2O
C. 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
D. 稀硫酸中滴加氢氧化钡溶液:H++ OH—=H2O
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】在溶液中![]() 能与
能与![]() 按
按![]() 结合形成多种粒子,六步反应的平衡常数依次用
结合形成多种粒子,六步反应的平衡常数依次用![]() 表示。25℃时,各粒子的物质的量分数
表示。25℃时,各粒子的物质的量分数![]() 与
与![]() 的关系如图所示。下列叙述正确的是( )
的关系如图所示。下列叙述正确的是( )
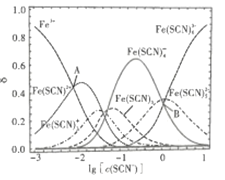
A. ![]() 依次增大
依次增大
B. 已知图中A点![]() 的值为-2.21,则
的值为-2.21,则![]()
C. ![]() 的
的![]()
D. 若图中B点![]() 的值为b、则
的值为b、则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾( KAl(SO4)2·12H2O)。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
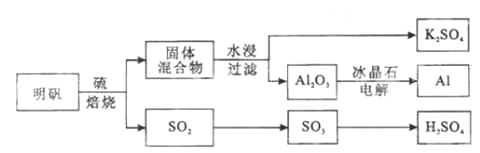
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________。
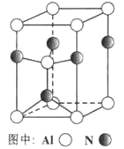
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)![]() 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)![]() Z(g)+W(s) △H>0,下列叙述正确的是
Z(g)+W(s) △H>0,下列叙述正确的是
A. 在容器中加入氩气,反应速率不变
B. 加入少量W,逆反应速率增大
C. 升高温度,正反应速率增大,逆反应速率减小
D. 将容器的体积压缩,可增大活化分子的百分数.有效碰撞次数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
B. 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C. AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D. CaCO3 难溶于稀硫酸,但可溶于醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
I.(1)AlCl3的水溶液pH______7(填>、=、<=,其原因为______________(用离子方程式表示),将其溶液加热蒸干并灼烧最终得到物质是_____________________(填化学式)。
(2)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至___。
(3)物质的量浓度相同的三种溶液:①(NH4)2SO4 ②氨水 ③NH4HSO4,c(NH4+)大小顺序正确的是______。(用序号表示)
(4)常温下两种溶液:a.pH=4 NH4Cl b.pH=4盐酸溶液,其中水电离出C(H+)之比为______。
II.室温下,某一元弱酸HA的电离常数K=1.6×10-6。 向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1 的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
(1)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用________作指示剂,滴定终点在___(填“c点以上”或“c点以下”)。
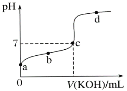
(2)滴定过程中部分操作如下,下列各操作使测量结果偏高的是___________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(3)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_______mol/L。(保留4位有效数字)
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断错误的是( )
A.NA个H+的质量为1 g
B.46g NO2和N2O4混合气体所含氧原子数目为2NA
C.在常温常压下,11.2L N2含有的分子数小于0.5NA
D.56g铁与足量的盐酸反应,转移的电子为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com