
【题目】短周期主族元素X、Y、Z、W、R、Q原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的0.1mol/L水溶液pH如下表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是

A. W和Q形成的化合物只含有离子键
B. Y和Z的氢化物沸点:Y<Z
C. 离子半径:r(Q>r(R)>r(Z)
D. Y和Q氧化物的水化物酸性:Q>Y
【答案】A
【解析】
0.1mol/L甲溶液pH为13,说明甲为一元强碱,则甲为NaOH;0.1mol/L丁溶液pH为1,说明丁为一元强酸,则丁为HCl;乙、丙的0.1mol/L水溶液pH分别为11、5,则乙为弱碱性溶液,丙为弱酸性溶液;甲溶液逐滴滴入丙溶液中,先 产生白色沉淀,后沉淀消失,则丙溶液中含有铝离子,可能为AlCl3;乙的水溶液可除油污,可能为Na2CO3溶液,结合短周期主族元素X、Y、Z、W、R、Q原子序数依次增大,化合物甲、乙、丙、丁由这些元素组成分析解答。
根据上述分析,甲为NaOH,丁为HCl;若丙为AlCl3;乙为Na2CO3溶液,涉及6种元素,根据短周期主族元素X、Y、Z、W、R、Q原子序数依次增大,化合物甲、乙、丙、丁由这些元素组成,则X为H元素、Y为C元素、Z为O元素、W为Na元素、R为Al元素、Q为Cl元素。
A. W和Q形成的化合物为氯化钠,只含有离子键,故A正确;
B. Y为C,C的氢化物有很多种,氢化物沸点可能大于水也可能小于水,故B错误;
C. 离子的电子层数越多,离子半径越大,电子层结构相同的离子,核电荷数越大,离子半径越小,因此离子半径:r(Q>r(Z)>r(R),故C错误;
D. Y和Q氧化物的水化物可能为碳酸和次氯酸,此时酸性:Q<Y,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】汽车、工厂等污染源排入大气的碳氢化合物和氮氧化物等一次污染物,在紫外光作用下发生光化学反应生成了二次污染物。光化学烟雾是一次污染物和二次污染物的混合物。
(1)汽车尾气中含有CO、NO及碳氢化合物等。
①CO的来源是_______(用文字说明)。
②NO的来源是______(用方程式说明)。
③C8H18在汽缸中可裂解生成丙烯和戊烷等,戊烷的同分异构体有______种。
(2)文献报道了一种研究模拟光化学烟雾产生的实验,将添加丙烯和NO的空气在烟雾箱中用紫外线照射,各物质浓度的消长关系如图所示:

①下列说法正确的是_____(填标号)。
A.O3具有强氧化性 B.在光反应过程中NO最终全部转变为NO2
C.二次污染物只有乙醛 D.0~120min生成PAN的反应速率最快
②写出CH3CH=CH2被O3氧化为甲醛和乙醛的化学方程式______(注:每消耗1molO3,同时生成1molO2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3是灰黑色、有光泽的固体,主要用作陶瓷、搪瓷和玻璃的着色颜料,也可用于制备镍粉。以废镍料为原料提取Ni2O3的工艺流程如图所示。

请回答下列问题:
(1)镍的某种化合物NiOOH,其中Ni的化合价为___________。
(2)加入双氧水“氧化”的离子方程式为____________________;滤渣A的主要成分是________________(填化学式)。
(3)步骤①中为了控制“氧化”效率,最佳物质的量之比NaOH/NaClO =________。
(4)步骤②电解法制取Ni2O3,用NaOH调酸溶后溶液的pH至7.5,加入适量Na2SO4后以惰性电极电解。电解过程中产生的Cl2有约40%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。加入Na2SO4的作用__________________________;当有n mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量约为____________。
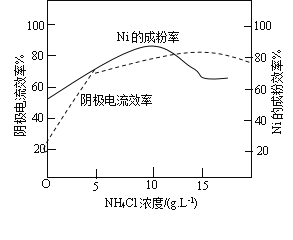
(5)工业上,镍作阳极,电解0.1molL-1NiCl2溶液与一定量NH4Cl溶液组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电极上实际沉积的物质的量与理论析出量之比)及Ni的成粉的影响如图所示。
① 为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为__________gL-1。
② 当NH4Cl浓度大于15gL-1时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是

A. 反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应开始到10 s,用Z表示的反应速率为0.3 mol·L-1·s-1
C. 10 s后,该反应停止进行
D. 反应开始到10 s时,反应速率:υ(X)=υ(Y)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)D中所含官能团的名称是_____________。
(2)反应③的化学方程式是_________________________________。
(3)G是一种高分子化合物,可以用来制造农用薄膜材料等,其结构简式是___________。
(4)在体育竞技比赛中,当运动员肌肉挫伤或扭伤时,随队医生立即对准其受伤部位喷射物质F(沸点12.27℃)进行应急处理。A制备F的化学方程式是_____________。
(5)B与D反应加入浓硫酸的作用是_________;为了得到较纯的E,需除去E中含有的D,最好的处理方法是_____________(用序号填写)。
a.蒸馏 b.用过量饱和碳酸钠溶液洗涤后分液 c.水洗后分液 d.用过量氯化钠溶液洗涤后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲检验集气瓶中是否收集满SO2气体,则置于瓶口的滤纸应蘸有的溶液是( )
A.BaCl2溶液B.酸性KMnO4溶液
C.KI淀粉溶液D.澄清的石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于研究物质性质的基本程序的步骤顺序正确的是( )
①观察物质的外部特征
②实验和观察
③解释和结论
④预测物质的性质
A.①④②③B.①②③④C.②①③④D.①④③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为满足不同的需要,人们应用原电池原理制作了多种电池。
(1)有人以化学反应2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则该原电池负极的电极反应为___________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,其反应的离子方程式为________________;若将此反应设计或原电池,则负极所用电极材料为___________,正极反应为_________________。
(3)美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中A、B两个电极均由多孔的碳炔组成,该电池的正极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,完成下列问题: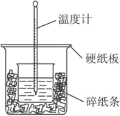
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。请指出装置中的另外错误是 ________________________
(2)烧杯间填满碎纸条的作用是___________。
(3)大烧杯上如不盖硬纸板,求得的中和热值___________(填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50mol·L-1的盐酸跟60 mL 0.55mol·L-1NaOH溶液进行上述实验相比,所放出的热量___________(填“相等”“不相等”),所求中和热___________(填“相等”“不相等”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com