
 。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中, |
D.混合溶液中, |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.0molS02 | B.2molS03 | C.1mol02 | D.1molSO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 催化剂 |
| 180℃ |
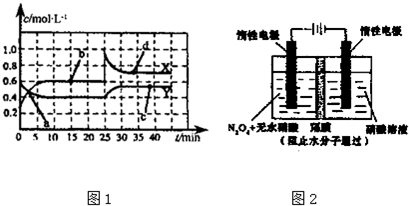
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.100mL蒸馏水中; | B.100mL 0.2 mol·L-1AgNO3溶液中; |
| C.100 mL 0.1 mol·L-1AlCl3溶液中; | D.100mL 0.1 mol·L-1盐酸溶液中。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.12.3 | B.11 | C.3 | D.1.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中: c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B.20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中: c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中: c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
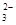 )+c(HCO
)+c(HCO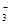 )]
)]| A.①④ | B.②③ | C.①③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2H2+O2=2H2OΔH=-142.9 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l)ΔH=-142.9 kJ·mol-1 |
| C.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(l)ΔH=+571.6 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com