
【题目】为确定盐酸、碳酸、硅酸的酸性强弱,设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。(提示:检验酸的酸性强弱可用强酸制取弱酸)
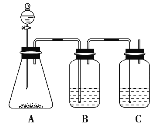
(1)锥形瓶中装某可溶性正盐,分液漏斗中所盛试剂应为________。
(2)装置B中所盛试剂是________________________________________,其作用是_____________。
(3)装置C中所盛试剂是___________________________________________,
C中反应的离子方程式是_________________________________________________。
(4)由此得到的结论是酸性:________>________>________。___________
【答案】(1)盐酸
(2)饱和NaHCO3溶液 吸收HCl气体
(3)Na2SiO3溶液 SiO+CO2+H2O===H2SiO3↓+CO
(4)HCl H2CO3H2SiO3
【解析】
根据强酸+弱酸盐―→弱酸+强酸盐分析可知,分液漏斗中盛装盐酸,A中盛放Na2CO3溶液,根据Na2CO3+2HCl===2NaCl+H2O+CO2↑可知酸性HCl强于H2CO3,然后将生成的CO2通入Na2SiO3溶液中,发生反应:Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,由此判断酸性H2CO3>H2SiO3,应注意分液漏斗中盐酸是挥发性酸,反应时有HCl气体逸出,故气体通入Na2SiO3溶液前应用饱和NaHCO3溶液吸收HCl。


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
A. x=1
B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1
D. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由二氧化硅制高纯硅的流程如下,下列判断中错误的是( )
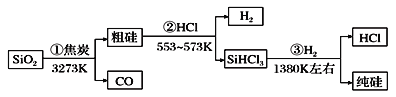
A. SiHCl3摩尔质量为135.5 g B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. ①②③均属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞中四种有机化合物的组成及主要功能。回答下列问题:
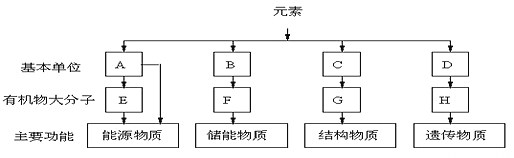
(1)图中的基本单位A是_________。利用A合成的E主要分布在人和动物的_________中,当人和动物血液中的A低于正常含量时,一些细胞中的E便分解产生A及时补充。
(2)与图中的E相比,F是细胞内更良好的储能物质,原因是____________。分布在内脏器官周围的F还具有_________的作用,可以保护内脏器官。
(3)图中的C在生物体中约有20种,其中有一部分在人体细胞不能合成,必须从外界环境中直接获取,这部分C叫做_________。由C形成G时,C分子之间通过_________(用化学结构简式表示)连接。
(4)图中H的中文名称是_________,烟草叶肉细胞的H彻底水解的产物是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列实验方法合理的是________。
A.用加热法除去碳酸钠固体中的碳酸氢钠
B.将碘的饱和水溶液中的碘提取出来,可用酒精进行萃取
C.实验室制取Al(OH)3:向AlCl3溶液中加入NaOH溶液至过量
D.向FeCl2溶液中滴入KSCN溶液,检验FeCl2是否已氧化变质
(2)某研究性学习小组为研究氯气是否具有漂白性,设计如图所示实验装置。试根据实验装置回答下列问题:

A、C中为干燥的有色布条,B为无色液体,D中为NaOH溶液。
① 在常温下,KMnO4固体可以与浓盐酸反应生成氯气,其反应方程式为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,则其反应装置应选用甲、乙、丙中的________。
② B中的液体为____________,其作用为_________________________________。
③ A、C中有色布条的颜色变化分别为__________________________________,A、C的实验现象说明氯气是否具有漂白性?________(填“是”或“否”)。
④ D中NaOH溶液的作用是_______________________(用离子方程式说明)。
⑤ 将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色褪去。小组内有甲、乙两种意见:
甲:氯气溶于水后溶液显酸性,中和了NaOH,使溶液褪为无色;
乙:氯气溶于水生成漂白性物质,使溶液褪为无色。
丙同学在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未见红色,则 ________(填“甲”或“乙”)的意见正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值。下列说法正确的是
A. 标准状况下,11.2L苯中含有分子的数目为0.5NA
B. 常温常压下,1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
C. 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子数目为0.4NA
D. 25℃时,pH=13的氢氧化钠溶液中含有OH-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式的书写不正确的是
A. 金属钠和水反应:2Na+2H2O=2Na++2OH-+H2↑
B. NH4HCO3溶液中加入过量的NaOH溶液并加热:NH4++OH- ![]() NH3↑+H2O
NH3↑+H2O
C. 把氯气通入NaOH 溶液中:Cl2+2OH-=Cl-+ClO-+H2O
D. 金属铜与稀硝酸反应: 3Cu+8H++2NO3- ![]() 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
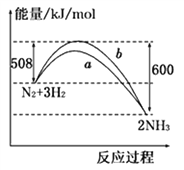
A. 该反应的热化学方程式为:N2+ 3H2![]() 2NH3, △H = -92kJ·mol-1
2NH3, △H = -92kJ·mol-1
B. 加入催化剂, 该化学反应的ΔH不改变
C. b曲线是加入催化剂时的能量变化曲线
D. 在温度体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。
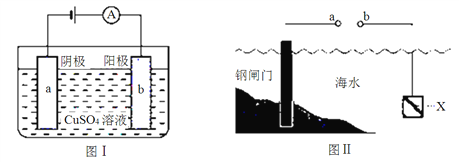
下列说法不正确的是
A. 图Ⅰ中a为纯铜
B. 图Ⅰ中![]()
![]() 向b极移动
向b极移动
C. 图Ⅱ中如果a、b间连接电源,则a连接负极
D. 图Ⅱ中如果a、b间用导线连接,则X可以是铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com