
����Ŀ������ȩ��һ�ֻ���ԭ�ϡ�ijʵ��С����������װ�úϳ�����ȩ��
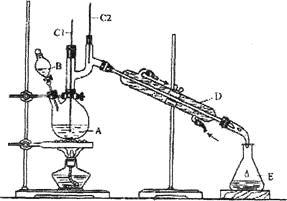
�����ķ�Ӧ���£�
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
��Ӧ��Ͳ������������б����£�
�е�/�� | �ܶ�/(g��cm��3) | ˮ���ܽ��� | |
������ | 117.2 | 0.8109 | �� |
����ȩ | 75.7 | 0.8017 | �� |
ʵ�鲽�����£�
��6.0gNa2Cr2O7����100mL�ձ��У���30mLˮ�ܽ⣬�ٻ�������5mLŨ���ᣬ��������ҺС��ת����B�С���A�м���4.0g�������ͼ�����ʯ�����ȡ�������������ʱ����ʼ�μ�B����Һ���μӹ����б��ַ�Ӧ�¶�Ϊ90~95������E���ռ�90�����µ���֡�������ﵹ���Һ©���У���ȥˮ�㣬�л������������ռ�75~77����֣�����2.0g���ش��������⣺
��1������װ��ͼ�У�B������������__________��D������������__________��
��2�������ʯ��������__________��
��3����Һ©��ʹ��ǰ������еIJ�����__________ (����ȷ�𰸱��)��
a����ʪ b������ c����© d���궨
��4��������ȩ�ֲ�Ʒ���ڷ�Һ©���з�ˮʱ��ˮ��__________��(����������������)��
��5����Ӧ�¶�Ӧ������90~95������ԭ����______________________________��
��6����ʵ���У�����ȩ�IJ���Ϊ__________����
���𰸡���Һ©�� ֱ�������� ��ֹ���� c �� ��֤����ȩ��ʱ�������ֿɾ��������䱻��һ������ 51.4
��������
��1��B�����������Ƿ�Һ©����D����������ֱ�������ܣ��ʴ�Ϊ��Һ©����ֱ�������ܣ�
��2�������ʯ�������Ƿ�ֹ���У��ʴ�Ϊ��ֹ���У�
��3����Һ©��ʹ��ǰ�����©����ѡc��
��4������ȩ����ˮ������ȩ���ܶ�Ϊ0.8017 gcm-3��С��ˮ���ܶȣ��ʷֲ�ˮ�����·����ʴ�Ϊ�£�
��5�������ӦΪ��������������Ӧ��˵��Na2Cr2O7���������ԣ�������ȩ�к�ȩ��������������Ӧ���������ȩ�ķе����ݿ�֪����Ӧ�¶ȱ�����90��95�����ȿɱ�֤����ȩ��ʱ�������ֿɾ��������䱻��һ���������ʴ�Ϊ��֤����ȩ��ʱ�������ֿɾ��������䱻��һ��������
��6�����ݷ�ӦCH3CH2CH2CH2OH![]() CH3CH2CH2CHO����������������ȩ������Ϊ
CH3CH2CH2CHO����������������ȩ������Ϊ![]() ��72g/mol=3.89g��������ȩ�IJ���Ϊ
��72g/mol=3.89g��������ȩ�IJ���Ϊ![]() ��100%=51.4���ʴ�Ϊ51.4��
��100%=51.4���ʴ�Ϊ51.4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��N��S����Ҫ�ķǽ���Ԫ�أ���Ҫ��ش��������⣺
��1���̵����к��е�CO��SO2����Ҫ����Ⱦ����ڴ��������½�����ת��ΪS(s)��CO2���˷�Ӧ���Ȼ�ѧ����ʽΪ______________________________________________________��
��֪��CO(g)+1/2O2(g)=CO2(g) ��H=��283.0 kJ��mol��1
S(s)+O2(g)=SO2(g) ��H=��296.0 kJ��mol��1��
��2����ס���������Ϊ1 L���ܱ������У��ֱ����5 mol SO2��3 mol O2��������Ӧ��2SO2(g)+
O2(g)![]() 2SO3(g) ��H��0�����������¶�ΪT1�������·�Ӧ���ﵽƽ��ʱSO3�����ʵ���Ϊ4.5 mol�����������¶�ΪT2�������·�Ӧ���ﵽƽ��ʱSO3�����ʵ���Ϊ4.6 mol����T1___T2�����������������������������з�Ӧ��ƽ�ⳣ��K=_____________________��
2SO3(g) ��H��0�����������¶�ΪT1�������·�Ӧ���ﵽƽ��ʱSO3�����ʵ���Ϊ4.5 mol�����������¶�ΪT2�������·�Ӧ���ﵽƽ��ʱSO3�����ʵ���Ϊ4.6 mol����T1___T2�����������������������������з�Ӧ��ƽ�ⳣ��K=_____________________��
��3����ͼ��ʾ��A�Ǻ��ݵ��ܱ�������B��һ������ɱ�ij������ҡ����ֺ��£��ر�K2���ֱ�1 mol N2��3 mol H2ͨ��K1��K3����A��B�У������ķ�ӦΪ��N2(g)+3H2(g) ![]() 2NH3(g)����ʼʱA��B�������ͬ��Ϊa L��
2NH3(g)����ʼʱA��B�������ͬ��Ϊa L��
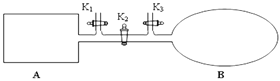
������ʾ��ͼ����˵��A�����з�Ӧ�ﵽƽ��״̬������˵��B�����з�Ӧ�ﵽƽ��״̬����______��
������A�з�Ӧ����ƽ��ʱ����ʱ��t s���ﵽƽ���������ѹǿ��Ϊԭ����5/6����ƽ����Ӧ������(H2)=___________________________��
��4����0.1 mol�����ֱ�ͨ��1 L pH=1�����ᡢ����ʹ�����Һ�У���ȫ��Ӧ������Һ��NH4+����Ũ�ȷֱ�Ϊc1��c2��c3��������Ũ�ȴ�С�Ĺ�ϵΪ____________������c1��c2��c3�ͣ�������=����ʾ������֪�������Һ�����ԣ�������CH3COOH��Ka=1��10��5 mol��L��1������¶���NH4Cl��ˮ�ⳣ��K h Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ͼװ�õ�������ȷ����
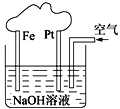
A. ��Һ��Na+��Fe���ƶ�
B. ��װ����PtΪ�������缫��ӦΪ��O2 + 2H2O + 4e===4OH
C. ��װ����FeΪ�������缫��ӦΪ��Fe2e===Fe2+
D. ��ԭ���װ�����յIJ�����Fe(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȡ��������ֳ����ķǽ���Ԫ�ء�
���������գ�
��1���������ȵ��Ĵ���֮һ�ڻ�ҩ�ı�ը��ӦΪ��S+2KNO3+3C A+N2��+3CO2��������ƽ������ԭ�Ӻ�������Ų�ʽΪ______________����������� A����_____���塣
��2����ҵ�ϳɰ�����ʵ�ִ��ģ�̵����������������Ȼ�李�����淋Ȼ�ѧ���ϣ������ʵ���Ũ�ȵ�����Һ��ͬ�¶���pH��СΪ���Ȼ��___________����泥�ѡ��>��=��<����
��3����ҵ���ڴ��������£���NH3��Ϊ��ԭ���������е�NO2��ԭ�����ĵ�����ˮ����Ӧ����ʽ�ɱ�ʾΪ��8NH3��g����6NO2��g��![]() 7N2��g����12H2O��g�����õ����ű���÷�Ӧ����ת�Ƶķ������Ŀ______�����÷�Ӧ��������Ȼ�ԭ�����0.1mol�������յ�NO2�ڱ�״���µ����Ϊ_________��
7N2��g����12H2O��g�����õ����ű���÷�Ӧ����ת�Ƶķ������Ŀ______�����÷�Ӧ��������Ȼ�ԭ�����0.1mol�������յ�NO2�ڱ�״���µ����Ϊ_________��
��4����ˮ�ɷֵĶ����Ծ����������ʵĸ����ԣ���������������ˮ���������е���������д��������Ҫ�Ļ�ѧ��Ӧ����ʽ______________________________������������Һ�еμ���ˮ�����Կ����а�ɫ���������������õ�����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���![]() ��һ����Ҫ�Ļ�����Ʒ��ij��ȤС�����Ʊ����Ȼ�����
��һ����Ҫ�Ļ�����Ʒ��ij��ȤС�����Ʊ����Ȼ�����
I.���������ϣ�
���� | �۵� | �е� | ��ѧ���� |
Sn | 231 | 227 | ����ʱ�� |
| 246 | 652 |
|
|
| 114 | ����ˮ�� |
��![]() ���Ʊ���Ʒ��
���Ʊ���Ʒ��
ʵ��װ����ͼ��ʾ![]() ʡ�Լгֺͼ���װ��
ʡ�Լгֺͼ���װ��![]()
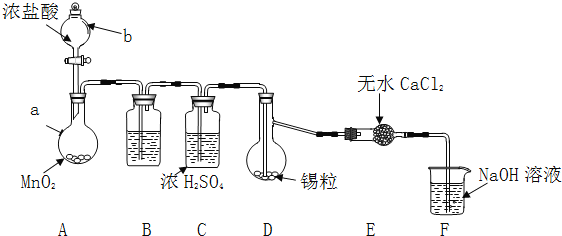
ʵ�鲽�裺
(1)���װ�������Ժ�ͼʾ�����Լ�������b�������� ______ ��������ˮ![]() �������� ______ ��B�е��Լ��� ______
�������� ______ ��B�е��Լ��� ______ ![]() ѡ��������ĸ���
ѡ��������ĸ���![]() ��
��
A.![]() ��Һ
��Һ ![]() ��Һ
��Һ
![]() ����NaCl��Һ
����NaCl��Һ ![]() ��Һ
��Һ
(2)����A����ƿ�ڼ������Ტ����a��������װ�� ______ ��![]() ��ʵ������
��ʵ������![]() ���ټ����ۻ���������Ӧ���ֹͣ���ȡ�
���ټ����ۻ���������Ӧ���ֹͣ���ȡ�
(3)����Ӧ������ ______ ![]() ��д��������
��д��������![]() ��ϴ�ӡ�����ɻ�������װ��A��δ��Ӧ���
��ϴ�ӡ�����ɻ�������װ��A��δ��Ӧ���![]() ��
��
��![]() ̽���뷴˼
̽���뷴˼![]()
(1)װ��F������![]() ������Ӧ�����ӷ���ʽ�� ______ ��
������Ӧ�����ӷ���ʽ�� ______ ��
(2)ʵ����D�еõ��IJ�Ʒ���٣�������װ�������ȱ�ݣ�Ӧ��D��E֮�䲹�� ______ ![]() ��װ������
��װ������![]() ��
��
(3)Ϊ��֤��Ʒ���Ƿ���![]() ����С�����������ʵ�鷽����
����С�����������ʵ�鷽����![]() �����Լ���ϡ
�����Լ���ϡ![]() ��ϡHCl��
��ϡHCl��![]() ��Һ��
��Һ��![]() ��Һ��KSCN��Һ������ˮ��ѡ��
��Һ��KSCN��Һ������ˮ��ѡ��![]()
ȡ����![]() ��Ʒ����20mL����ˮ�У����� ______ ���� ______
��Ʒ����20mL����ˮ�У����� ______ ���� ______ ![]() ��ʵ������
��ʵ������![]() ������
������![]() ��������
��������![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������磺���ᡢ̼�ᡢ�����ᡢһˮ�ϰ��ȣ���֪25��ʱ�����ᡢ̼�ᡢ������ĵ���ƽ�ⳣ�����±�
������ | ̼�� | ���� |
Ka=6.2��10-10 | Ka1=4.2��10-7 Ka2=5.6��10-11 | Ka=1.7��10-5 |
��1��25��ʱ��pH��ȵ�������Һ��CH3COONa��Һ����Na2CO3��Һ����NaCN��Һ��Ũ���ɴ�С��˳��Ϊ____(�����)��
��2��25��ʱ����NaCN��Һ��ͨ������CO2����Ӧ�����ӷ���ʽΪ_________��
��3����Ũ��Ϊ0.02mol/L��HCN ��0.01mol/LNaOH ��Һ�������ϣ�������Һ��c(H+) _____c(OH-)���� < > = ��գ�
��4�������£���Ũ��Ϊ0.1 mol��L��1�����ΪV L�İ�ˮ����μ���һ��Ũ�ȵ����ᣬ��pH�Ʋ���Һ��pH������ļ����������͵ĵζ����ߣ�d��������Һǡ����ȫ��Ӧ������ͼ����Ϣ�ش��������⣺
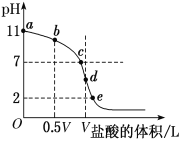
�ٸ��¶�ʱNH3��H2O�ĵ��볣��K��______��
�ڱȽ�b��c��d����ʱ����Һ�У���ˮ�������c(H��)�ɴ�С˳��Ϊ________��
�۵ζ�ʱ����b�㵽c��Ĺ����У����и�ѡ������ֵ���ֲ������________(����ĸ����ͬ)��
A��c(H��)��c(OH-) B. ![]()
C.  D.
D. ![]()
�ܸ������ϵζ������ж�����˵����ȷ����________(��Һ��NԪ��ֻ����NH![]() ��NH3��H2O������ʽ)��
��NH3��H2O������ʽ)��
A����b��ʾ��Һ�У�c(NH![]() )��c(H��)��c(OH��)��c(NH3��H2O)
)��c(H��)��c(OH��)��c(NH3��H2O)
B����c��ʾ��Һ�У�c(Cl��)��c(NH3��H2O)��c(NH![]() )
)
C����d��ʾ��Һ�У�c(Cl��)>c(H��)>c(NH![]() )>c(OH��)
)>c(OH��)
D���ζ������п����У�c(NH3��H2O)>c(NH![]() )>c(OH��)>c(Cl��)>c(H��)
)>c(OH��)>c(Cl��)>c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϯ���������ڴ���ҩ��ȷ�����;�㷺��ij��ϯ���ĺϳ�·�ߢ����£�
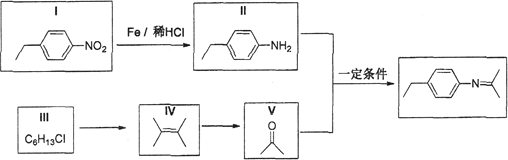
(1)���ķ���ʽΪ__________��1molV��ȫȼ��������Ҫ����__________mol O2��
(2)III��NaOHˮ��Һ���ȷ�Ӧ����ѧ����ʽΪ___________________________��
(3)IV�����ۺϷ�Ӧ���ɵĸ߷��ӻ�����Ľṹ��ʽΪ_____________________��
(4)��Ϻϳ�·�ߢ٣��������ºϳ�·�ߢڣ�
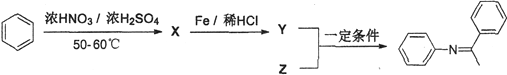
X�Ľṹ��ʽΪ__________��Z�Ľṹ��ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��Ϊ��̽��SO2��ʵ�����Ʒ����йػ�ѧ���ʣ���������µ�ʵ�顣
ʵ��I��
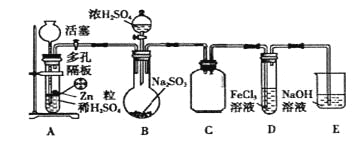
��1��ʵ���������
����������������ϣ�����������_____________________________________.
����ʵ����H2ʱ����Ũ��������480mL 3 mol��L��ϡ���ᣬ����������IJ���������250 mL�ձ���l 00mL��Ͳ������������ͷ�ιܵȣ�����_______________________.
����ʵ�������H2�����������_____________________________.
��2��ʵ��ʱ�ȴ�������װ��A���Լ���Ӧһ��ʱ��رջ���������װ��B�е�������Ũ���ᷴӦƬ�̺ס�����ѧ���ֱ�ȡװ��D��������Һ����ѧ�������м�������KMnO4��Һ���۲쵽����KMnO4��Һ�Ϻ�ɫ��ȥ����ѧ�������м��������ữ��BaCl2��Һ���۲쵽�а�ɫ�������ɡ����ݸ���ʵ������ס���ѧ���ó�SO2��Fe3+������
�����жϼס���ѧ���Ľ����Ƿ��Ͻ�________________(��дѡ��)��
A����ѧ���Ͻ� B����ѧ���Ͻ� C���ס���ѧ�������Ͻ�
��д��SO2��Fe3+���������ӷ�Ӧ����ʽ_____________________________________.
ʵ��II��
��3�����о�С��Ϊ�ⶨSO2������ΪSO3��ת���ʣ������������ʵ��:��֪SO3�۵�Ϊ16.8�����Һ��Կ�����CO2��Ӱ��).
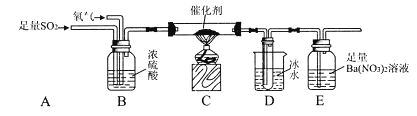
����ֹͣͨ��SO2��Ϩ��ƾ��ƺ���Ҫ����ͨ����������Ŀ���ǣ�____________________.
��ʵ���������װ��D���ӵ�����Ϊm g��װ��E�в�����ɫ����������Ϊn g,��������¶��������ת������_______________(�ú���ĸ�Ĵ���ʽ��ʾ�����û���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ұ���������ѧ������������ǵ�ת����ϵ��ͼ��ʾ![]() ijЩ�����Ͳ��ֲ�������ȥ
ijЩ�����Ͳ��ֲ�������ȥ![]() ����˵���������
����˵���������![]()
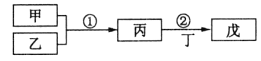
A.����Ϊһ��ǿ������ɫ��ӦΪ��ɫ����Ӧ![]() ���ܶ�����������ԭ��Ӧ
���ܶ�����������ԭ��Ӧ
B.�����£�����Ϊ��ɫ���壬��Ϊ����ɫ���壬��ס�����ͭ��ϡ����
C.����Ϊ���ȼ�ղ����Ϊˮ����������ڸ����
D.����ΪŨ���ᣬ��Ϊ![]() ���������ʹƷ����ɫ
���������ʹƷ����ɫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com