
【题目】甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示![]() 某些条件和部分产物已略去
某些条件和部分产物已略去![]() 下列说法错误的是
下列说法错误的是![]()
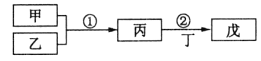
A.若戊为一种强碱且焰色反应为黄色,则反应![]() 可能都属于氧化还原反应
可能都属于氧化还原反应
B.常温下,若丙为无色气体,戊为红棕色气体,则甲、乙是铜和稀硝酸
C.若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲
D.若甲为浓盐酸,乙为![]() ,则戊可能使品红褪色
,则戊可能使品红褪色
【答案】B
【解析】
![]() 若戊为一种强碱且焰色反应为黄色,则戊为NaOH,结合图中转化可知,甲、乙分别为Na和氧气,丙可以是氧化钠或过氧化钠,丁为
若戊为一种强碱且焰色反应为黄色,则戊为NaOH,结合图中转化可知,甲、乙分别为Na和氧气,丙可以是氧化钠或过氧化钠,丁为![]() ,若丙为过氧化钠时,反应
,若丙为过氧化钠时,反应![]() 中均有元素的化合价变化,则都属于氧化还原反应,故A正确;
中均有元素的化合价变化,则都属于氧化还原反应,故A正确;
B.常温下,若丙为无色气体,戊为红棕色气体,可知丙为NO,戊为![]() ,丁为
,丁为![]() ,甲、乙是铜和稀硝酸,二者反应生成NO,也可以是其它金属和稀硝酸的反应生成NO,故B错误;
,甲、乙是铜和稀硝酸,二者反应生成NO,也可以是其它金属和稀硝酸的反应生成NO,故B错误;
C.若甲为硫磺燃烧产物即为![]() ,则丙为
,则丙为![]() ,丁为
,丁为![]() ,戊为硫酸,浓硫酸可干燥二氧化硫,故C正确;
,戊为硫酸,浓硫酸可干燥二氧化硫,故C正确;
D.若甲为浓盐酸,乙为![]() ,则丙为氯气,若丁为
,则丙为氯气,若丁为![]() ,则戊为HClO,HClO具有漂白性,则戊可能使品红褪色,故D正确;
,则戊为HClO,HClO具有漂白性,则戊可能使品红褪色,故D正确;
故选:B。


科目:高中化学 来源: 题型:
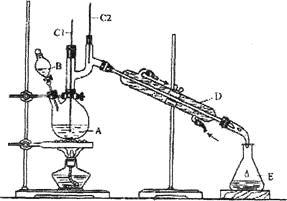
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm﹣3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。回答下列问题:
(1)上述装置图中,B仪器的名称是__________,D仪器的名称是__________;
(2)加入沸石的作用是__________;
(3)分液漏斗使用前必须进行的操作是__________ (填正确答案标号);
a.润湿 b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在__________层(填“上”或“下”);
(5)反应温度应保持在90~95℃。其原因是______________________________;
(6)本实验中,正丁醛的产率为__________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)。该蓄电池放电时,电解质溶液中 SO42-移向_____________(填“正”或“负”)极;一段时间后,负极增重 48g,转移电子___________mol。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极为_____极(填“a”或“b”)。
②电池工作一段时间后电解质溶液的 pH_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1L密闭容器中加入1.0molX,发生反应:![]()
![]() ,在14min时升高温度,X的物质的量浓度变化如图所示,下列说法正确的是
,在14min时升高温度,X的物质的量浓度变化如图所示,下列说法正确的是
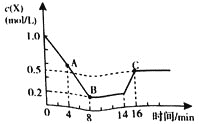
A.4min时,υ正<υ逆
B.8min和16min时反应均处于平衡状态,且两种情况下的正反应速率相等
C.反应至8min时,反应吸收200kJ热量
D.其它条件不变,若反应在绝热恒容容器中进行,当压强不变时反应就处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某大型化工生产的工艺流程图![]() 部分反应物或生成物已经略去
部分反应物或生成物已经略去![]() :
:
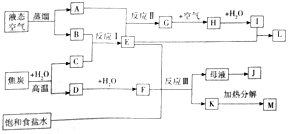
请回答下列问题:
![]() 流程中所涉及的化学工业有:合成氨、 ______ 联合制碱法
流程中所涉及的化学工业有:合成氨、 ______ 联合制碱法![]() 或侯式制碱法
或侯式制碱法![]() .
.
![]() 工业从液态空气中分离出A、B利用的原理是 ______ .
工业从液态空气中分离出A、B利用的原理是 ______ .
![]() 图示中G生成H的流程中为了提高原料的利用率和减少污染,生产中往往采取的操作是 ______ .
图示中G生成H的流程中为了提高原料的利用率和减少污染,生产中往往采取的操作是 ______ .
![]() 工业生产反应Ⅰ的方程式为 ______ ,为提高原料转化率的反应条件是 ______ ,生产中需将产物液化分离的目的是 ______ .
工业生产反应Ⅰ的方程式为 ______ ,为提高原料转化率的反应条件是 ______ ,生产中需将产物液化分离的目的是 ______ .
![]() 写出反应Ⅱ的化学方程式 ______ .
写出反应Ⅱ的化学方程式 ______ .
![]() 图示中生成小苏打的化学方程式 ______ ,母液与K分离的方法是 ______
图示中生成小苏打的化学方程式 ______ ,母液与K分离的方法是 ______ ![]() 有两种方案从母液中获得副产品J:
有两种方案从母液中获得副产品J:![]() 通入氨气、冷却、加食盐、过滤
通入氨气、冷却、加食盐、过滤![]() 不通氨气、冷却、加食盐、过滤对比这两种方案.方案
不通氨气、冷却、加食盐、过滤对比这两种方案.方案![]() 通入氨气的作用 ______ ;方案
通入氨气的作用 ______ ;方案![]() 滤液一般不能反复循环利用,其原因是 ______ .
滤液一般不能反复循环利用,其原因是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素的全部电离能(单位:eV)如下:
I1 | I2 | I3 | I4 | I5 | I6 | I7 | I8 |
13.6 | 35.1 | 54.9 | 77.4 | 113.9 | 138.1 | 739.1 | 871.1 |
写出该元素价电子轨道表示式_______________。
(2)分子中的大π 键可用符号![]() 表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为
表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为![]() 。
。
①试判断 SO2 最外层一共有_______________对孤对电子。
②HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-的键角为_______________,N![]() 中的大π 键应表示为_______________。
中的大π 键应表示为_______________。
(3)根据对角线规则,Be、Al 的化学性质相似,写出 Be(OH)2 与 NaOH 反应的离子方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答问题:
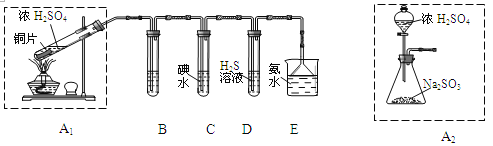
①装置A1中发生反应的化学方程式为 ;
②装置B用于检验SO2的漂白性,其中所盛试剂为 ,装置D用于检验SO2的 性质;
③装置C中反应的离子方程式为 ;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写二点) 、 ;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。
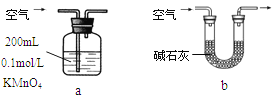
①你认为哪个装置可行(填序号) ,使用你所选用的装置测定SO2含量时,还需要测定的物理量是 ;
②你认为哪个装置不可行(填序号) ,说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质在一定条件下具有如下图所示的转化关系,下列判断错误的是

A. 若图中反应均为非氧化还原反应,当W为一元强碱时,则Z可能是NaAlO2
B. 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
C. 若图中反应均为非氧化还原反应,当W为一元强酸时则X可能是NH3
D. 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com