
����Ŀ��һ���¶��£���1L�ܱ������м���1.0molX��������Ӧ��![]()
![]() ����14minʱ�����¶ȣ�X�����ʵ���Ũ�ȱ仯��ͼ��ʾ������˵����ȷ����
����14minʱ�����¶ȣ�X�����ʵ���Ũ�ȱ仯��ͼ��ʾ������˵����ȷ����
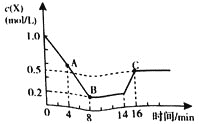
A.4minʱ������<����
B.8min��16minʱ��Ӧ������ƽ��״̬������������µ�����Ӧ�������
C.��Ӧ��8minʱ����Ӧ����200kJ����
D.�����������䣬����Ӧ�ھ��Ⱥ��������н��У���ѹǿ����ʱ��Ӧ�ʹ���ƽ��״̬
���𰸡�D
��������
A.4minʱ����Ӧ��Ũ�Ƚ��ͣ���Ӧ��δ�ﵽƽ��״̬��������>������ѡ��A����
B.14minʱ�ı�����Ϊ�����¶ȣ���Ӧ���ʼӿ죬��16minƽ��ʱ���������ʶ�����8minʱ������ͼʾ��֪�����߾�����ƽ��״̬��ѡ��B����
C.��Ӧ��8minʱ��X��Ũ�ȱ仯��Ϊ1.0mol/L-0.2mol/L=![]() ������X�����ʵ���Ϊ0.8mol/L��1L=0.8mol�����ݷ���ʽ��֪����ӦӦ���ͷ�����Ϊ200kJ��ѡ��C����
������X�����ʵ���Ϊ0.8mol/L��1L=0.8mol�����ݷ���ʽ��֪����ӦӦ���ͷ�����Ϊ200kJ��ѡ��C����
D.�����������䣬����Ӧ�ھ��Ⱥ��������н��У���ѹǿ����ʱ��Ӧ�ʹ���ƽ��״̬��ѡ��D��ȷ��
��ѡD��


 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȡ��������ֳ����ķǽ���Ԫ�ء�
���������գ�
��1���������ȵ��Ĵ���֮һ�ڻ�ҩ�ı�ը��ӦΪ��S+2KNO3+3C A+N2��+3CO2��������ƽ������ԭ�Ӻ�������Ų�ʽΪ______________����������� A����_____���塣
��2����ҵ�ϳɰ�����ʵ�ִ��ģ�̵����������������Ȼ�李�����淋Ȼ�ѧ���ϣ������ʵ���Ũ�ȵ�����Һ��ͬ�¶���pH��СΪ���Ȼ��___________����泥�ѡ��>��=��<����
��3����ҵ���ڴ��������£���NH3��Ϊ��ԭ���������е�NO2��ԭ�����ĵ�����ˮ����Ӧ����ʽ�ɱ�ʾΪ��8NH3��g����6NO2��g��![]() 7N2��g����12H2O��g�����õ����ű���÷�Ӧ����ת�Ƶķ������Ŀ______�����÷�Ӧ��������Ȼ�ԭ�����0.1mol�������յ�NO2�ڱ�״���µ����Ϊ_________��
7N2��g����12H2O��g�����õ����ű���÷�Ӧ����ת�Ƶķ������Ŀ______�����÷�Ӧ��������Ȼ�ԭ�����0.1mol�������յ�NO2�ڱ�״���µ����Ϊ_________��
��4����ˮ�ɷֵĶ����Ծ����������ʵĸ����ԣ���������������ˮ���������е���������д��������Ҫ�Ļ�ѧ��Ӧ����ʽ______________________________������������Һ�еμ���ˮ�����Կ����а�ɫ���������������õ�����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��Ϊ��̽��SO2��ʵ�����Ʒ����йػ�ѧ���ʣ���������µ�ʵ�顣
ʵ��I��
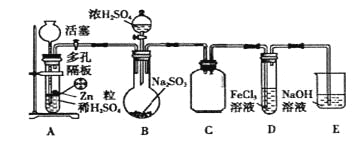
��1��ʵ���������
����������������ϣ�����������_____________________________________.
����ʵ����H2ʱ����Ũ��������480mL 3 mol��L��ϡ���ᣬ����������IJ���������250 mL�ձ���l 00mL��Ͳ������������ͷ�ιܵȣ�����_______________________.
����ʵ�������H2�����������_____________________________.
��2��ʵ��ʱ�ȴ�������װ��A���Լ���Ӧһ��ʱ��رջ���������װ��B�е�������Ũ���ᷴӦƬ�̺ס�����ѧ���ֱ�ȡװ��D��������Һ����ѧ�������м�������KMnO4��Һ���۲쵽����KMnO4��Һ�Ϻ�ɫ��ȥ����ѧ�������м��������ữ��BaCl2��Һ���۲쵽�а�ɫ�������ɡ����ݸ���ʵ������ס���ѧ���ó�SO2��Fe3+������
�����жϼס���ѧ���Ľ����Ƿ��Ͻ�________________(��дѡ��)��
A����ѧ���Ͻ� B����ѧ���Ͻ� C���ס���ѧ�������Ͻ�
��д��SO2��Fe3+���������ӷ�Ӧ����ʽ_____________________________________.
ʵ��II��
��3�����о�С��Ϊ�ⶨSO2������ΪSO3��ת���ʣ������������ʵ��:��֪SO3�۵�Ϊ16.8�����Һ��Կ�����CO2��Ӱ��).
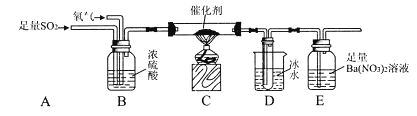
����ֹͣͨ��SO2��Ϩ��ƾ��ƺ���Ҫ����ͨ����������Ŀ���ǣ�____________________.
��ʵ���������װ��D���ӵ�����Ϊm g��װ��E�в�����ɫ����������Ϊn g,��������¶��������ת������_______________(�ú���ĸ�Ĵ���ʽ��ʾ�����û���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������н��з�Ӧ��mX(g)��nY(g)![]() pZ(g)��qQ(g)��ʽ��m��n��p��qΪ��ѧ����������0��3min�ڣ����������ʵ����ı仯���±���ʾ��
pZ(g)��qQ(g)��ʽ��m��n��p��qΪ��ѧ����������0��3min�ڣ����������ʵ����ı仯���±���ʾ��
���� | X | Y | Z | Q |
��ʼ/mol | 0.7 | 1 | ||
2minĩ/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3minĩ/mol | 0.8 |
��֪��2min�ڣ���(Q)��0.075mol��L��1��min��1����(Z)�æ�(Y)��1��2��
��1������ʽ��m��______��n��______��p��______��q��______��
��2��2.5min�ڣ�Q��ת����Ϊ______________��
��3�����ڸ÷�Ӧ������������Ӧ���ʵĴ�ʩ��___________
A������������� B�����߲���Q C��ͨ�����X D�������¶�
��4���÷�Ӧ�ﵽ��ѧƽ��״̬ʱ___________
A������������ѹǿ���ֲ��� B�������������ܶȱ��ֲ���
C������������ƽ��Ħ���������ֲ��� D������Ӧ�������淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ 2CH3OH(g)![]() C2H4(g)+2H2O(g)�� ij�о�С�齫�״�������һ�������ٳ���ͨ����ͬ����ͬ�ִ����� ��ͬ�¶ȵõ�����ͼ�� �����н��۲���ȷ����
C2H4(g)+2H2O(g)�� ij�о�С�齫�״�������һ�������ٳ���ͨ����ͬ����ͬ�ִ����� ��ͬ�¶ȵõ�����ͼ�� �����н��۲���ȷ����
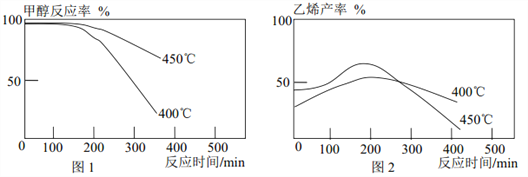
A. һ��ʱ���״���Ӧ���½������Ǵ��������½�
B. �ۺ�ͼ 1�� ͼ 2 ��֪�� �״���������������Ӧ
C. ���ı�״����������٣� ����Ӱ��״���Ӧ�ʺ���ϩ����
D. ����ϩ�Ƚ����˵��¶��� 450������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ӵ�س��ʱ�Ĺ���ԭ����ͼ��ʾ��LiCoO2�е�Li+��������ϩ�ױ�Ĥ����Ǩ�Ʋ�Ƕ��ʯī��C6��ʾ���С�����˵��������ǣ� ��
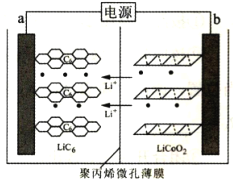
A.���ʱ�������缫��ӦʽΪLiCoO2-xe-=xLi++Lil-xCoO2
B.�ŵ�ʱ���õ�ؽ���ѧ��ת��Ϊ����
C.�ŵ�ʱ��b��Ϊ����������������Ӧ
D.����ܷ�ӦΪLixC6+Lil-xCoO2![]() C6+LiCoO2
C6+LiCoO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ұ���������ѧ������������ǵ�ת����ϵ��ͼ��ʾ![]() ijЩ�����Ͳ��ֲ�������ȥ
ijЩ�����Ͳ��ֲ�������ȥ![]() ����˵���������
����˵���������![]()
A.����Ϊһ��ǿ������ɫ��ӦΪ��ɫ����Ӧ![]() ���ܶ�����������ԭ��Ӧ
���ܶ�����������ԭ��Ӧ
B.�����£�����Ϊ��ɫ���壬��Ϊ����ɫ���壬��ס�����ͭ��ϡ����
C.����Ϊ���ȼ�ղ����Ϊˮ����������ڸ����
D.����ΪŨ���ᣬ��Ϊ![]() ���������ʹƷ����ɫ
���������ʹƷ����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶��µ�ˮ��Һ�У�c(H��)=10xmol��L��1 ��c(OH��)=10ymol��L��1��x��y�Ĺ�ϵ��ͼ��ʾ������֪lg2=0.3��
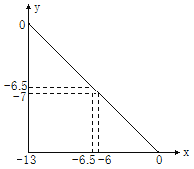
(1)ˮ�����ӻ�Ϊ___________________��
(2)0.01mol��L-1 H2SO4��Һ��pH=________��
(3)pH��7����Һ��________ (������������������������������)��
(4) �����ij��Һ�У�ˮ���������c(OH��)��1.0��10��12 mol��L��1������ҺΪǿ����Һ�������Һ��pH��______���к�100 mL����Һ������HCl�����ʵ���Ϊ______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ס��飨As�����ࣨSb�����飨Bi�����ң�Mc��Ϊԭ���������������ͬ��Ԫ�ء����������գ�
��1������Ԫ�����ڱ��е�λ����___��![]() Mcԭ�Ӻ�������������������֮��Ϊ___��
Mcԭ�Ӻ�������������������֮��Ϊ___��
��2����֪��P��s�����ף�![]() P��s�����ף�-17.6kJ��P��s�����ף�
P��s�����ף�-17.6kJ��P��s�����ף�![]() P��s�����ף�+39.3kJ�����ס����ס����ۻ�Ϊ___���������ȶ�����___��
P��s�����ף�+39.3kJ�����ס����ס����ۻ�Ϊ___���������ȶ�����___��
��3��SbCl3�ܷ�����ǿ��ˮ�⣺Sb3++Cl-+H2O![]() SbOCl��+2H+����ˮ�ⷴӦ��ƽ�ⳣ������ʽΪ____������SbCl3��ҺӦע��___��
SbOCl��+2H+����ˮ�ⷴӦ��ƽ�ⳣ������ʽΪ____������SbCl3��ҺӦע��___��
��4��д���ܹ��Ƚ�����������������Ӧˮ��������ǿ����һ��ʵ����ʵ___��
��5����ѧ�ҷ�������H2������ˮ�������ε���Ⱦ�ķ�������ԭ�����Ա�ʾΪ��5H2+2NO![]()
 N2+2OH-+4H2O��25��ʱ����Ӧ����10min����ˮ��pH��7��Ϊ12�����ʱ����NO
N2+2OH-+4H2O��25��ʱ����Ӧ����10min����ˮ��pH��7��Ϊ12�����ʱ����NO![]() ��ƽ����Ӧ����Ϊ__��
��ƽ����Ӧ����Ϊ__��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com