
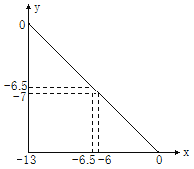
【题目】在某温度下的水溶液中,c(H+)=10xmol·L﹣1 ,c(OH﹣)=10ymol·L﹣1。x与y的关系如图所示:(已知lg2=0.3)
(1)水的离子积为___________________。
(2)0.01mol·L-1 H2SO4溶液的pH=________。
(3)pH=7的溶液呈________ (填“酸性”、“中性”或“碱性”)。
(4) 若测得某溶液中,水电离出来的c(OH-)=1.0×10-12 mol·L-1,且溶液为强碱溶液,则该溶液的pH=______。中和100 mL该溶液需消耗HCl的物质的量为______mol。
【答案】10-13 mol2·L-2 1.7 碱性 12 0.01
【解析】
(1)由图像可知 x+y =-13,可算出水的离子积常数 K w = c(H +) c (OH-)= 10xmol·L-1 ×10ymol·L-1 =![]()
(2) 计算出0.01mol·L-1 H2SO4溶液中氢离子的浓度,利用pH=- lgc(H+)可计算出数值;
(3)比较溶液的酸碱性要看氢离子和氢氧根离子的相对大小,利用水的离子积常数知道pH=6.5时溶液为中性,则可以判断则pH=7的溶液呈碱性;
(4)不论何种溶液中水电离出的氢离子和氢氧根离子的浓度都相等,若测得某溶液中,水电离出来的c(OH-)=1.0×10-12 mol·L-1,且溶液为强碱溶液,则该碱溶液的氢离子来自于水的电离,可算出pH,根据酸碱中和的原理,氢离子的物质的量和氢氧根离子的物质的量相等,算出消耗HCl的物质的量。
(1) 水的离子积 K w = c(H +) c(OH-)= 10xmol·L-1 ×10ymol·L-1 =![]() mol2·L-2,由图像可知 x+y =-13,故 K w =10 -13 mol2·L-2,
mol2·L-2,由图像可知 x+y =-13,故 K w =10 -13 mol2·L-2,
答案为:10 -13 mol2·L-2;
(2)0.01mol·L-1 H2SO4溶液中氢离子的浓度为0.01 mol·L-1×2=0.02 mol·L-1,则pH=-lg(2×10-2)=2- lg2=2-0.3=1.7,
答案为:1.7;
(3)该温度下, K w =10 -13,即当pH=6.5时溶液为中性,则pH=7的溶液呈碱性,
答案为:碱性;
(4) 不论何种溶液中水电离出的氢离子和氢氧根离子的浓度都相等,若测得某溶液中,水电离出来的c(OH-)=1.0×10-12 mol·L-1,且溶液为强碱溶液,则该强碱溶液的氢离子来自于水的电离,因此溶液中的氢离子浓度等于水电离出的氢氧根离子的浓度=1.0×10-12 mol·L-1,则该溶液的pH=-lg c(H+)=-lg(1.0×10-12)=12;该溶液中c(OH-)= 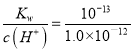 mol·L-1=0.1 mol·L-1,则100 mL该溶液中n(OH-)=0.1L×0.1 mol·L-1=0.01mol,根据H + +OH - = H2O,需消耗HCl的物质的量为0.01mol,
mol·L-1=0.1 mol·L-1,则100 mL该溶液中n(OH-)=0.1L×0.1 mol·L-1=0.01mol,根据H + +OH - = H2O,需消耗HCl的物质的量为0.01mol,
答案为:12;0.01。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1L密闭容器中加入1.0molX,发生反应:![]()
![]() ,在14min时升高温度,X的物质的量浓度变化如图所示,下列说法正确的是
,在14min时升高温度,X的物质的量浓度变化如图所示,下列说法正确的是
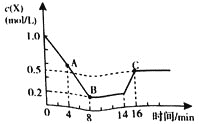
A.4min时,υ正<υ逆
B.8min和16min时反应均处于平衡状态,且两种情况下的正反应速率相等
C.反应至8min时,反应吸收200kJ热量
D.其它条件不变,若反应在绝热恒容容器中进行,当压强不变时反应就处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素的全部电离能(单位:eV)如下:
I1 | I2 | I3 | I4 | I5 | I6 | I7 | I8 |
13.6 | 35.1 | 54.9 | 77.4 | 113.9 | 138.1 | 739.1 | 871.1 |
写出该元素价电子轨道表示式_______________。
(2)分子中的大π 键可用符号![]() 表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为
表示,其中 m 代表参与形成大 π 键的原子数,n 代表参与形成大π 键的电子数,如苯分子中的大 π 键可表示为![]() 。
。
①试判断 SO2 最外层一共有_______________对孤对电子。
②HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-的键角为_______________,N![]() 中的大π 键应表示为_______________。
中的大π 键应表示为_______________。
(3)根据对角线规则,Be、Al 的化学性质相似,写出 Be(OH)2 与 NaOH 反应的离子方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答问题:
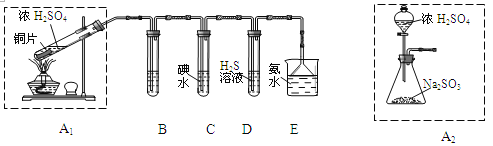
①装置A1中发生反应的化学方程式为 ;
②装置B用于检验SO2的漂白性,其中所盛试剂为 ,装置D用于检验SO2的 性质;
③装置C中反应的离子方程式为 ;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写二点) 、 ;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。
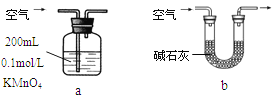
①你认为哪个装置可行(填序号) ,使用你所选用的装置测定SO2含量时,还需要测定的物理量是 ;
②你认为哪个装置不可行(填序号) ,说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得常温下0.1mol/L某一元酸HA溶液的pH值大于1,0.1mol/L某一元碱BOH溶液里![]() =10-12。将此两种溶液等体积混合后,所得溶液的各离子的浓度由大到小排列的顺序( )
=10-12。将此两种溶液等体积混合后,所得溶液的各离子的浓度由大到小排列的顺序( )
A.c(B+)>c(A-)>c(OH-)>c(H+)B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)=c(A-)>c(H+)=c(OH-)D.c(B+)>c(A-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1NaOH溶液分别滴定20.00mL 0.1 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
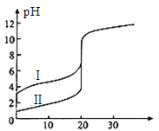
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)> c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )

实验编号 | 温度℃ | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com