
����Ŀ����Na2FeO4��Һ������ˮ�еĻ�ԭ����Ⱦ��M��Ϊ�о�����Ч����������¶Ա�ʵ��̽���¶ȡ�Ũ�ȡ� pH�������Խ������ʺ�Ч����Ӱ�죬ʵ����M��Ũ����ʱ���ϵ��ͼ��ʾ������˵������ȷ���ǣ�������

ʵ���� | �¶ȡ� | pH |
�� | 25 | 1 |
�� | 45 | 1 |
�� | 25 | 7 |
�� | 25 | 1 |
A.ʵ�����15 min��M�Ľ�������Ϊ1.33��10��5mol/��L��min��
B.������������ͬ��ʵ��٢�˵�������¶ȣ�M������������
C.������������ͬ��ʵ��٢�֤��pHԽ�ߣ�Խ������M�Ľ���
D.ʵ���˵��M��Ũ��ԽС�����������Խ��
���𰸡�D
��������
A����ͼ�����ݣ���֪15 min�ڡ�c��M��=��0.3mol/L-0.1mol/L����10-3=2��10-4mol/L����v��M��=![]() =1.33��l0-5mol/��Lmin������A��ȷ��
=1.33��l0-5mol/��Lmin������A��ȷ��
B����ͼ�����߱仯�ɿ���ʵ��������ʵ��٣�M�������������ɱ������ݿ�֪������������ͬ��ʵ��ڵ��¶ȸߣ�����˵�������¶ȣ�M������������B��ȷ��
C����ͼ�����߱仯�ɿ���ʵ��������ʵ��ۣ�M�������������ɱ������ݿ�֪������������ͬ��ʵ��۵�pH�ߣ�����˵��pHԽ�ߣ�Խ������M�Ľ��⣬��C��ȷ��
D������ͼʾ��֪��M����ʼŨ��ԽС����������ԽС����D����
��ѡ��D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶��µ�ˮ��Һ�У�c(H��)=10xmol��L��1 ��c(OH��)=10ymol��L��1��x��y�Ĺ�ϵ��ͼ��ʾ������֪lg2=0.3��
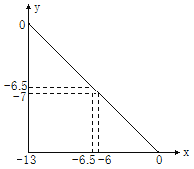
(1)ˮ�����ӻ�Ϊ___________________��
(2)0.01mol��L-1 H2SO4��Һ��pH=________��
(3)pH��7����Һ��________ (������������������������������)��
(4) �����ij��Һ�У�ˮ���������c(OH��)��1.0��10��12 mol��L��1������ҺΪǿ����Һ�������Һ��pH��______���к�100 mL����Һ������HCl�����ʵ���Ϊ______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ס��飨As�����ࣨSb�����飨Bi�����ң�Mc��Ϊԭ���������������ͬ��Ԫ�ء����������գ�
��1������Ԫ�����ڱ��е�λ����___��![]() Mcԭ�Ӻ�������������������֮��Ϊ___��
Mcԭ�Ӻ�������������������֮��Ϊ___��
��2����֪��P��s�����ף�![]() P��s�����ף�-17.6kJ��P��s�����ף�
P��s�����ף�-17.6kJ��P��s�����ף�![]() P��s�����ף�+39.3kJ�����ס����ס����ۻ�Ϊ___���������ȶ�����___��
P��s�����ף�+39.3kJ�����ס����ס����ۻ�Ϊ___���������ȶ�����___��
��3��SbCl3�ܷ�����ǿ��ˮ�⣺Sb3++Cl-+H2O![]() SbOCl��+2H+����ˮ�ⷴӦ��ƽ�ⳣ������ʽΪ____������SbCl3��ҺӦע��___��
SbOCl��+2H+����ˮ�ⷴӦ��ƽ�ⳣ������ʽΪ____������SbCl3��ҺӦע��___��
��4��д���ܹ��Ƚ�����������������Ӧˮ��������ǿ����һ��ʵ����ʵ___��
��5����ѧ�ҷ�������H2������ˮ�������ε���Ⱦ�ķ�������ԭ�����Ա�ʾΪ��5H2+2NO![]()
 N2+2OH-+4H2O��25��ʱ����Ӧ����10min����ˮ��pH��7��Ϊ12�����ʱ����NO
N2+2OH-+4H2O��25��ʱ����Ӧ����10min����ˮ��pH��7��Ϊ12�����ʱ����NO![]() ��ƽ����Ӧ����Ϊ__��
��ƽ����Ӧ����Ϊ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�ɷ��Ƕ���������ij��ѧʵ��С��ȡ1.0g��������Ʒ�ڿ����г������ʱ������Ӧ4FeS2+11O2![]() 2Fe2O3+8SO2(�������ʲ��μӷ�Ӧ)�����ɵ�SO2����ǡ�ñ�50mLFe2(SO4)3��Һ��ȫ���գ���������Һ�м�������BaCl2��Һ��ַ�Ӧ���ˡ�ϴ�ӡ������13.98g���塣�ش��������⣺
2Fe2O3+8SO2(�������ʲ��μӷ�Ӧ)�����ɵ�SO2����ǡ�ñ�50mLFe2(SO4)3��Һ��ȫ���գ���������Һ�м�������BaCl2��Һ��ַ�Ӧ���ˡ�ϴ�ӡ������13.98g���塣�ش��������⣺
(1)FeS2�ڿ���������ʱ�����ϼ����ߵ�Ԫ����__________��SO2��Fe2(SO4)3��Ӧ�Ļ�ѧ����ʽ��_________________��
(2)ԭFe2(SO4)3��Һ�����ʵ���Ũ��Ϊ_______����������FeS2����������Ϊ______��
(3)��ҵ������10 t��������������SO2�������������ᣬ�����Ͽ��Ƶ�98����Ũ������ٶ�______��(��ʽ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ѧ�������ʴ���ת����ϵ��A+B��C+D+H2O������C�������࣬�����ƶϲ���ȷ����
A.��AΪ����ɫ���壬��D������Ư����
B.��AΪ��ɫ�������ʣ���Dһ���Ǻ���ɫ����
C.��AΪ�����Dһ����ʹ����ʯ��ˮ�����
D.��AΪ�Ȼ�泥���Dһ���Ǿ��д̼�����ζ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
��1��ʵ������ͨ����NaOH��Һ����ϴ�����ᴿ������100mL3mol��L-1��NaOH��Һ���ձ�״����4.48LCO2ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ__��
��2�������£���һ�������0.1mol��L-1�Ĵ�����Һ�м�ˮϡ�ͺ�����˵����ȷ����__(����ĸ)��
A.��Һ�е������ӵ���Ŀ����
B.����ĵ���̶�����c(H+)Ҳ����
C.��Һ��![]() ����
����
D.��Һ��![]() ��С
��С
��3���ٳ����½�0.15mol��L-1��ϡ����V1mL��0.1mol��L-1��NaOH��ҺV2mL��ϣ�������Һ��pHΪ1����V1��V2=__(��Һ����ı仯���Բ���)��
�ڳ���������Һ��pH=3��HA��ҺV1mL��pH=11��NaOH��ҺV2mL��϶��ã�������˵����ȷ����__(����ĸ)��
A.����Ϻ���Һ�����ԣ���c(H+)+c(OH-)=2��10-7mol��L-1
B.��V1=V2����Ϻ���Һ��pHһ������7
C.����Ϻ���Һ�����ԣ���V1һ������V2
D.����Ϻ���Һ�ʼ��ԣ���V1һ��С��V2
��4�������£�Ũ�Ⱦ�Ϊ0.1mol��L-1������������Һ��pH�����ʾ��
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
�ٸ��ݱ������ݣ���Ũ�Ⱦ�Ϊ0.01mol��L-1���������������Һ�ֱ�ϡ��100����pH�仯��С����__(����ĸ)��
A.HCN B.HClO C.H2CO3 D.CH3COOH
�ڸ����������ݣ��ж����з�Ӧ���Գ�������__(����ĸ)��
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2��
��5���������ӿ�ʼ����ʱ��pH�����ʾ��
���� | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
������ͬŨ��Cu2+��Mg2+��Fe2+����Һ�еμ�NaOH��Һʱ��__(�����ӷ���)�ȳ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��ͬѧ��̽�� NH3�Ļ�ԭ��ʵ�飬����ͼװ�ý���ʵ�顣
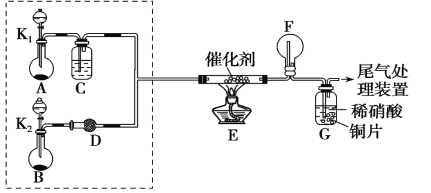
A��B װ�ÿ�ѡҩƷ��Ũ��ˮ��H2O2������ˮ��NaOH ���塢MnO2
(1)��ȡ NH3 ������һװ����_________��(�� A �� B)
(2)NH3 �������Ļ�ѧ����ʽ��___________��
(3)������ͬѧ�ֱ�����װ�ý���ʵ�顣�۲쵽װ�� F ���к���ɫ���壬�ҹ۲쵽װ��F��ֻ�а������ɣ����̵ijɷ���(д��ѧʽ)___________��
(4)��С�黹������ͼ��ʾװ��̽�� NH3 �ܷ� NO2 ����(K1��K2Ϊֹˮ�У��г̶ֹ�װ����ȥ)��
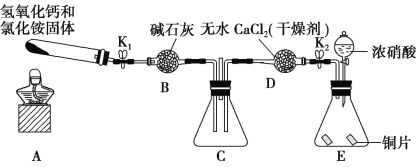
A�з�����Ӧ�Ļ�ѧ����ʽΪ____________��
(5)���� C װ���� NH3 �ܱ� NO2 ����ȫ�����������ʣ�����˷�Ӧת�Ƶ��� 0.4mol�������ı�״���µ� NO2__________________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ⱥ����ܱ�������ͨ��![]() ��
��![]() ����һ��������ʹ��Ӧ
����һ��������ʹ��Ӧ![]() �ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ��ʾ����ͼ�ɵó�����ȷ������
�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ��ʾ����ͼ�ɵó�����ȷ������
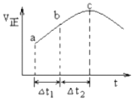
A.��c��������������ɫ���ٸı�
B.����������������ڷ�Ӧ���������
C.![]() ʱ��
ʱ��![]() ��ת���ʣ�
��ת���ʣ�![]() ��С��
����![]() ��
��
D.�ں��º����ܱ�������ͨ����ͬ��![]() ��
��![]() ����Ӧ��ƽ��ת����С�ھ��Ⱥ�������
����Ӧ��ƽ��ת����С�ھ��Ⱥ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦH2(g)��Cl2(g)=2HCl(g)�������仯��ͼ��ʾ��������˵������ȷ����
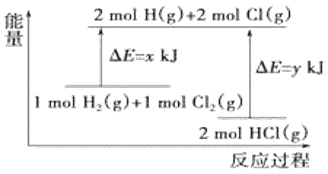
A.�÷�Ӧ�����ȷ�Ӧ
B.����1molH-H����1molCl-Cl��ʱ�ܷų�x kJ������
C.����2molH-Cl��ʱ��Ҫ����y kJ������
D.2molHCl(g)������������1molH2(g)��1molCl2(g)��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com