
【题目】向绝热恒容密闭容器中通入![]() 和
和![]() ,在一定条件下使反应
,在一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
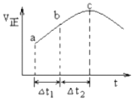
A.在c点容器内气体颜色不再改变
B.生成物的总能量高于反应物的总能量
C.![]() 时,
时,![]() 的转化率:
的转化率:![]() 段小于
段小于![]() 段
段
D.在恒温恒容密闭容器中通入相同的![]() 和
和![]() ,反应物平衡转化率小于绝热恒容容器
,反应物平衡转化率小于绝热恒容容器
【答案】C
【解析】
反应开始时,反应物浓度最大,则正反应速率应该最大,随着反应的进行,正反应速率应该减小,但图象中正反应速率却逐渐增大,说明反应为放热反应,温度升高,当反应进行到一定阶段时,由于反应物浓度逐渐减小,则反应速率逐渐减小,据此分析解答。
![]() 当正反应速率不变时,达到化学平衡状态,但c点反应速率最大,虽然正反应速率减小,但反应继续向正反应方向进行,没有达到平衡状态,所以c点容器内气体颜色变浅,故A错误;
当正反应速率不变时,达到化学平衡状态,但c点反应速率最大,虽然正反应速率减小,但反应继续向正反应方向进行,没有达到平衡状态,所以c点容器内气体颜色变浅,故A错误;
B. 该反应正向放热,所以反应物总能量大于生成物总能量,故B错误;
C. a点到b点,b点到c点反应均未达到平衡,随着反应的进行,体系温度升高,反应速率加快,![]() 的转化率增大,所以
的转化率增大,所以![]() 的转化率:
的转化率:![]() 段小于
段小于![]() 段,故C正确;
段,故C正确;
D. 反应正向放热,绝热恒容密闭容器中温度升高,恒温恒容密闭容器中通入相同的![]() 和
和![]() 的反应体系相当在绝热恒容体系中降温,平衡正向进行,反应物平衡转化率增大,所以恒温恒容密闭容器中通入相同的
的反应体系相当在绝热恒容体系中降温,平衡正向进行,反应物平衡转化率增大,所以恒温恒容密闭容器中通入相同的![]() 和
和![]() ,反应物平衡转化率大于绝热恒容容器,故D错误;
,反应物平衡转化率大于绝热恒容容器,故D错误;
故选C。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1NaOH溶液分别滴定20.00mL 0.1 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
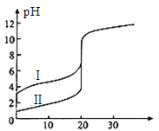
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)> c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )

实验编号 | 温度℃ | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为__。
(2)B为0.1mol·L-1NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:__。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入__以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为_。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
①100mL蒸馏水中;②100mL0.2mol·L-1AgNO3溶液中;③100mL0.1mol·L-1氯化铝溶液中;④100mL0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是__(填序号);向②中加入足量氯化银后,氯离子的浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草酸广泛用于食品调味剂, 作香精、 香料, 合成线路如下:

(1)C 的结构简式是_____, B 转化为 C 的反应类型为_____。
(2)A 中含有的官能团名称是_____。
(3)B 的分子式是_____。
(4)在 B 中滴入 FeCl3溶液, 其现象是_____。
(5)与 F 官能团相同的芳香族化合物的同分异构体有_____种。
(6)写出 F 与乙醇进行酯化反应的方程式_____。
(7)写出由 的合成线路图_____。
的合成线路图_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:
①KCl ②CH4 ③NH4NO3 ④I2 ⑤Na2O2 ⑥HClO4 ⑦N2 ⑧CO ⑨SO2 ⑩金刚石 CH3CH2OH MgO MgCl2 KOH HCl Al2O3
请回答下列问题。
(1)两性氧化物是___(填序号),其电子式为___。
(2)最简单的有机化合物是___(填序号),用电子式表示其形成过程:___。
(3)属于共价化合物的是___(填序号),含有共价键的离子化合物是___(填序号)。
(4)由两种元素组成,且含有离子键和共价键的化合物为___(填序号),这两种元素的单质反应生成该化合物的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。
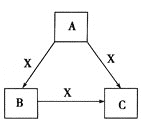
请针对以下三种不同情况回答:
![]() 若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
![]() 中含有的金属元素在元素周期表中的位置为_______________________,向水中加入X物质,X对水的电离平衡的影响是_________
中含有的金属元素在元素周期表中的位置为_______________________,向水中加入X物质,X对水的电离平衡的影响是_________![]() 填“促进”、“抑制”或“无影响”
填“促进”、“抑制”或“无影响”![]() 。
。
![]() 与C的水溶液混合后生成B,反应的离子方程式为___________________________。
与C的水溶液混合后生成B,反应的离子方程式为___________________________。
![]() 若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成
若A为固态非金属单质,A与X同周期,同时A在X中燃烧,生成![]() 和
和![]() 白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
![]() 若A为该元素的白色固体单质,其结构为正四面体,分子式为
若A为该元素的白色固体单质,其结构为正四面体,分子式为![]() ,则
,则![]() 单质中含共价键数目为_________
单质中含共价键数目为_________![]() ,B的电子式为_________。
,B的电子式为_________。
![]() 与水反应的离子方程式为_______________________________________________。
与水反应的离子方程式为_______________________________________________。
![]() 若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
若A、B、C的焰色反应呈黄色,A为淡黄色固体,B、C的水溶液均为碱性,A溶于水后可与X反应生成C,常温下,X为气态酸性氧化物。
![]() 中所含有的化学键类型是_________。
中所含有的化学键类型是_________。
![]() 溶液中离子浓度由小到大的顺序是_________。
溶液中离子浓度由小到大的顺序是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用NO、O2和Na2CO3溶液反应制备NaNO2的装置如图所示,下列关于该装置的描述不正确的是( )
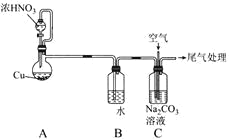
A.装置A分液漏斗中的药品选用不当,应选用稀HNO3
B.实验过程中,通过控制分液漏斗的活塞控制气流速度
C.装置C中发生反应的化学方程式为2Na2CO3+4NO+O2=4NaNO2+2CO2↑
D.实验过程中,装置C液面上方可能出现红棕色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为2L的密闭容器中,1molX和3molY进行反应:X(g)+3Y(g)![]() 2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )
2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )
A.以X浓度变化表示的反应速率为1/8mol/(L·S)
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的1/5
C.若增大X的浓度,则物质Y的转化率减小
D.若该反应的△H<0 ,升高温度,平衡常数K减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com