
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为__。
(2)B为0.1mol·L-1NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:__。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入__以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为_。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
①100mL蒸馏水中;②100mL0.2mol·L-1AgNO3溶液中;③100mL0.1mol·L-1氯化铝溶液中;④100mL0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是__(填序号);向②中加入足量氯化银后,氯离子的浓度为__mol·L-1。
【答案】c(NH![]() )>c(SO
)>c(SO![]() )>c(H+)>c(OH-) HCO
)>c(H+)>c(OH-) HCO![]() 的水解程度大于其电离程度,溶液中c(OH-)>c(H+),故溶液显碱性 盐酸 Fe3++3HCO
的水解程度大于其电离程度,溶液中c(OH-)>c(H+),故溶液显碱性 盐酸 Fe3++3HCO![]() =Fe(OH)3↓+3CO2↑ ②>①>④>③ 9×10-10
=Fe(OH)3↓+3CO2↑ ②>①>④>③ 9×10-10
【解析】
(1) (NH4)2SO4溶液中,铵根离子水解显酸性;
(2)碳酸氢根离子的水解程度大于电离程度;
(3) Fe3+水解呈酸性,NaHCO3水解呈碱性;
(4) 含有足量AgCl固体的饱和溶液中c(Ag+) c(Cl-)=Ksp(AgCl)=1.8×10-10;
(1) (NH4)2SO4溶液中,溶液中铵根离子水解显酸性,水解微弱,铵根离子浓度大于硫酸根离子,溶液中离子浓度大小为c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(2)在NaHCO3溶液中存在碳酸氢根离子的水解平衡为HCO3+H2O![]() H2CO3+OH-,电离平衡为HCO3-
H2CO3+OH-,电离平衡为HCO3-![]() H++CO32-;碳酸氢根离子的水解程度大于电离程度,所以显碱性;
H++CO32-;碳酸氢根离子的水解程度大于电离程度,所以显碱性;
(3) Fe3+水解呈酸性,配制FeCl3溶液时通常需要向其中加盐酸抑制Fe3+水解;NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体,反应的离子方程式为Fe3++3HCO3-=Fe(OH)3↓+3CO2↑;
(4) ①100mL蒸馏水中,c(Ag+)= c(Cl-),c(Ag+) c(Cl-)= 1.8×10-10,则c(Ag+)=![]() ;②100mL0.2mol·L-1AgNO3溶液中,c(Ag+)=0.2mol·L-1;③100mL0.1mol·L-1氯化铝溶液中,c(Cl-)=0.3mol·L-1,c(Ag+)=
;②100mL0.2mol·L-1AgNO3溶液中,c(Ag+)=0.2mol·L-1;③100mL0.1mol·L-1氯化铝溶液中,c(Cl-)=0.3mol·L-1,c(Ag+)= mol·L-1;④100mL0.1mol·L-1盐酸中c(Cl-)=0.1mol·L-1,c(Ag+)=
mol·L-1;④100mL0.1mol·L-1盐酸中c(Cl-)=0.1mol·L-1,c(Ag+)=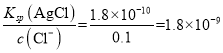 mol·L-1,c(Ag+)由大到小的顺序是②>①>④>③;向②中加入足量氯化银,c(Ag+)=0.2mol·L-1,c(Cl-)=
mol·L-1,c(Ag+)由大到小的顺序是②>①>④>③;向②中加入足量氯化银,c(Ag+)=0.2mol·L-1,c(Cl-)=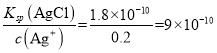 。
。


科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
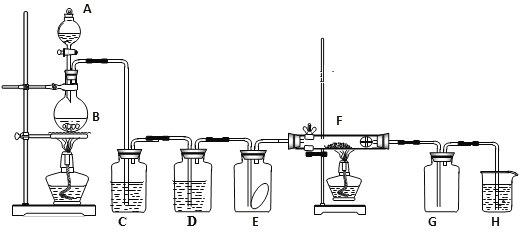
(1)装置C中盛装的溶液是____________,D中试剂的作用是________。
(2)E中的红色布条是否褪色?____(填“是”或“否”);写出F中反应的化学反应方程式:________________,其反应现象为_____________。
(3)新制氯水呈黄绿色说明其中含有_____,(填化学式,下同),若将紫色石蕊溶液滴入新制氯水中,可观察到的现象是_________________,说明其中含有__________。
(4)H中的试剂为___________,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白精,该反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿主要成分是二硫化亚铁。某化学实验小组取1.0g黄铁矿样品在空气中充分灼烧时发生反应4FeS2+11O2![]() 2Fe2O3+8SO2(假设杂质不参加反应),生成的SO2气体恰好被50mLFe2(SO4)3溶液完全吸收,在所得溶液中加入足量BaCl2溶液充分反应后,过滤、洗涤、干燥得13.98g固体。回答下列问题:
2Fe2O3+8SO2(假设杂质不参加反应),生成的SO2气体恰好被50mLFe2(SO4)3溶液完全吸收,在所得溶液中加入足量BaCl2溶液充分反应后,过滤、洗涤、干燥得13.98g固体。回答下列问题:
(1)FeS2在空气中灼烧时,化合价升高的元素是__________,SO2与Fe2(SO4)3反应的化学方程式是_________________。
(2)原Fe2(SO4)3溶液的物质的量浓度为_______,黄铁矿中FeS2的质量分数为______。
(3)工业上煅烧10 t上述黄铁矿,产生的SO2经催化氧化制硫酸,理论上可制得98%的浓硫酸多少吨______?(列式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100mL3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__。
(2)常温下,向一定体积的0.1mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是__(填字母)。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)也增大
C.溶液中![]() 不变
不变
D.溶液中![]() 减小
减小
(3)①常温下将0.15mol·L-1的稀硫酸V1mL与0.1mol·L-1的NaOH溶液V2mL混合,所得溶液的pH为1,则V1∶V2=__(溶液体积的变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是__(填字母)。
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol·L-1的下列五种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是__(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是__(填字母)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如表所示:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,__(填离子符号)先沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲探究 NH3的还原性实验,按如图装置进行实验。
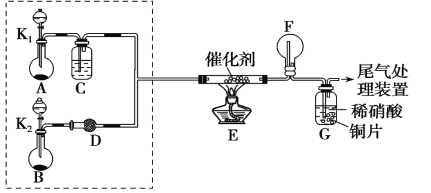
A、B 装置可选药品:浓氨水、H2O2、蒸馏水、NaOH 固体、MnO2
(1)制取 NH3 是在哪一装置中_________。(填 A 或 B)
(2)NH3 催化氧化的化学方程式是___________。
(3)甲乙两同学分别按上述装置进行实验。甲观察到装置 F 中有红棕色气体,乙观察到装置F中只有白烟生成,白烟的成分是(写化学式)___________。
(4)该小组还利用如图所示装置探究 NH3 能否被 NO2 氧化(K1、K2为止水夹,夹持固定装置略去)。
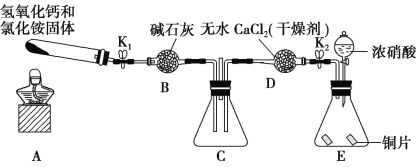
A中发生反应的化学方程式为____________。
(5)若在 C 装置中 NH3 能被 NO2 氧化全部生成无毒物质,假设此反应转移电子 0.4mol,则消耗标准状况下的 NO2__________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某吸水材料与聚酯纤维都是重要的化工原料。它们的合成路线如图所示:
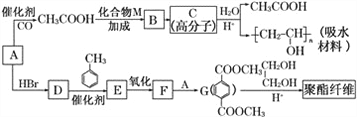
已知:①A由C、H、O三种元素组成,相对分子质量为32。
②RCOOR′+R″OH![]() RCOOR″+R′OH(R、R′、R″代表烃基)。
RCOOR″+R′OH(R、R′、R″代表烃基)。
请回答下列问题:
(1) A的结构简式是____________________。
(2)B中的官能团名称是______________________。
(3)D→E的反应类型是______________。
(4)①乙酸与化合物M反应的化学方程式是_________________________________
②G→聚酯纤维的化学方程式是______________。
(5) E的名称是___________。
(6) G的同分异构体有多种,满足下列条件的共有_____种。
①苯环上只有两个取代基;
② 1 mol该物质与足量的NaHCO3溶液反应生成2 mol CO2。
(7) 写出由![]() 合成
合成![]() 的流程图(注明反应条件)________。
的流程图(注明反应条件)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入![]() 和
和![]() ,在一定条件下使反应
,在一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
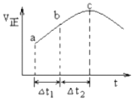
A.在c点容器内气体颜色不再改变
B.生成物的总能量高于反应物的总能量
C.![]() 时,
时,![]() 的转化率:
的转化率:![]() 段小于
段小于![]() 段
段
D.在恒温恒容密闭容器中通入相同的![]() 和
和![]() ,反应物平衡转化率小于绝热恒容容器
,反应物平衡转化率小于绝热恒容容器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 现有浓度均为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,回答下列问题:
①若三种溶液pH分别为a1、a2、a3,则它们pH由小到大顺序为__________。
②分别用以上三种酸中和等物质的量的NaOH溶液生成正盐,则需要体积最少的酸为________(填化学式)。
(2)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。常温下,0.1 mol·L-1HA溶液的pH=________,计算电离平衡常数K(HA)=_________。写出该酸(HA)与NaOH溶液反应的离子方程式:________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)古代锻造刀剑时,将炽热的刀剑快速投入水中“淬火”,反应为:3Fe+4H2O(g)![]() Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
(2)检验某溶液中是否含有SO42-,先加盐酸,再加______(填“BaCl2”或“NaCl;
(3)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是__________(填“生石灰”或“盐酸”)。
(4)过氧化钠可用于呼吸面具中作为氧气的来源。完成下列化学方程式:2Na2O2 + 2______ = 2Na2 CO3 +O2 ↑;
(5)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有________(填“钠”或“钾”)元素;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com