
【题目】实验测得常温下0.1mol/L某一元酸HA溶液的pH值大于1,0.1mol/L某一元碱BOH溶液里![]() =10-12。将此两种溶液等体积混合后,所得溶液的各离子的浓度由大到小排列的顺序( )
=10-12。将此两种溶液等体积混合后,所得溶液的各离子的浓度由大到小排列的顺序( )
A.c(B+)>c(A-)>c(OH-)>c(H+)B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)=c(A-)>c(H+)=c(OH-)D.c(B+)>c(A-)>c(H+)>c(OH-)
 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )

A. ![]() 时加入了催化剂B.
时加入了催化剂B. ![]() 时降低了温度
时降低了温度
C. ![]() 时增大了压强D.
时增大了压强D. ![]() 时间内转化率最高
时间内转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某锂离子电池充电时的工作原理如图所示,LiCoO2中的Li+穿过聚内烯微孔薄膜向左迁移并嵌入石墨(C6表示)中。下列说法错误的是( )
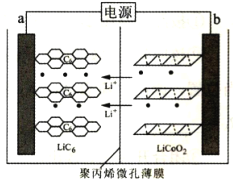
A.充电时,阳极电极反应式为LiCoO2-xe-=xLi++Lil-xCoO2
B.放电时,该电池将化学能转化为电能
C.放电时,b端为负极,发生氧化反应
D.电池总反应为LixC6+Lil-xCoO2![]() C6+LiCoO2
C6+LiCoO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D、E 五种主族元素分属三个短周期,且原子序数依次增大。A、C 同主族,可形成离子化合物 CA;B、D 同主族,可形成 DB2、DB3 两种分子。请回答下列问题:
(1)五种元素原子半径由小到大的顺序为_______________(用元素符号回答)。
(2)A、B 两种元素能形成既含极性键又含非极性键的化合物 M,M 的电子式为_______________。
(3)非金属性强弱:D_______________E(填“>”“<”),用离子方程式表示__________________________。
(4)写出均由 A、B、C、D 四种元素组成的两物质的浓溶液发生反应的离子方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下的水溶液中,c(H+)=10xmol·L﹣1 ,c(OH﹣)=10ymol·L﹣1。x与y的关系如图所示:(已知lg2=0.3)
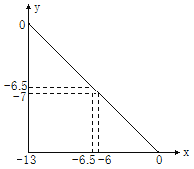
(1)水的离子积为___________________。
(2)0.01mol·L-1 H2SO4溶液的pH=________。
(3)pH=7的溶液呈________ (填“酸性”、“中性”或“碱性”)。
(4) 若测得某溶液中,水电离出来的c(OH-)=1.0×10-12 mol·L-1,且溶液为强碱溶液,则该溶液的pH=______。中和100 mL该溶液需消耗HCl的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a曲线表示一定条件下X(g)+Y(g)![]() 2Z(g)+W(s) △H<0的反应过程。若使a曲线变为b曲线,可采用的措施是 ( )
2Z(g)+W(s) △H<0的反应过程。若使a曲线变为b曲线,可采用的措施是 ( )
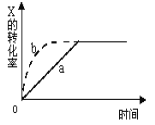
A.加入催化剂B.增大Y的浓度C.降低温度D.增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
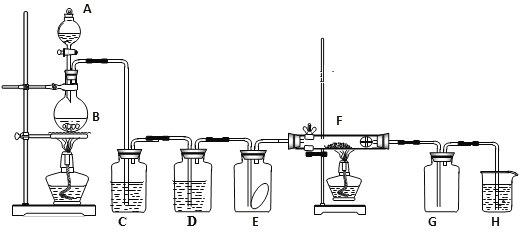
(1)装置C中盛装的溶液是____________,D中试剂的作用是________。
(2)E中的红色布条是否褪色?____(填“是”或“否”);写出F中反应的化学反应方程式:________________,其反应现象为_____________。
(3)新制氯水呈黄绿色说明其中含有_____,(填化学式,下同),若将紫色石蕊溶液滴入新制氯水中,可观察到的现象是_________________,说明其中含有__________。
(4)H中的试剂为___________,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白精,该反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是

A.CO、SO2、SO3均是酸性氧化物
B.工业上利用Cl2和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100mL3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__。
(2)常温下,向一定体积的0.1mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是__(填字母)。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)也增大
C.溶液中![]() 不变
不变
D.溶液中![]() 减小
减小
(3)①常温下将0.15mol·L-1的稀硫酸V1mL与0.1mol·L-1的NaOH溶液V2mL混合,所得溶液的pH为1,则V1∶V2=__(溶液体积的变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是__(填字母)。
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol·L-1的下列五种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是__(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是__(填字母)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如表所示:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,__(填离子符号)先沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com