
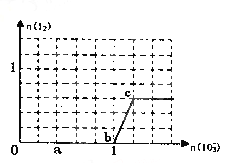
【题目】已知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,请回答下列问题
下列问题:
(1)a点处的氧化产物是_________(填化学式,下同),还原产物是_______,a点对应的离子方程式为_____。
(2)当n(I2)达到最大值时,n(IO3-)对应的最小值为____mol,此时反应的离子方程式是_____________。
(3)当溶液中的I-为0.4mol时,加入的KIO3为______mol。
(4)若向100mL 1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为____________。
【答案】 SO42- I- IO3-+3HSO3-=I-+3SO42-+3H+ 1.2 IO3-+5I-+6H+=3I2+3H2O 1.12或0.4 2IO3-+5HSO3-=I2+5SO42-+H2O+3H+
【解析】在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,还原性HSO3->I-,则首先发生反应:IO3-+3HSO3-=I-+3SO42-+3H+,HSO3-反应完全后,继续加入KIO3,由于氧化性IO3->I2,再发生反应:IO3-+5I-+6H+=3I2+3H2O。
(1).由图可知,a点没有生成碘,故发生的反应是:IO3-+3HSO3-=I-+3SO42-+3H+,反应中S元素化合价升高,还原剂是HSO3-,氧化产物是SO42-,I元素的化合价降低,IO3-是氧化剂,I-是还原产物,故答案为:SO42-;I-;IO3-+3HSO3-=I-+3SO42-+3H+;
(2).由图可知,b点到c点生成I2,则b点到c点发生反应:IO3-+5I-+6H+=3I2+3H2O,根据图象中的坐标数据可知,当n(I2)达到最大值时, n(IO3-)对应的最小值为1.2mol,故答案为:1.2;IO3-+5I-+6H+=3I2+3H2O;
(3).当溶液中的I-为0.4mol时,有两种情况:一是只发生反应IO3-+3HSO3-=I-+3SO42-+3H+,生成I-为0.4mol,根据碘原子守恒n(KIO3)=n(I-)=0.4mol;二是HSO3-反应完毕后,又发生IO3-+5I-+6H+=3I2+3H2O,剩余I-为0.4mol,3molNaHSO3消耗1molKIO3、生成1mol I-,故反应IO3-+5I-+6H+=3I2+3H2O中消耗的I-为1mol-0.4mol=0.6mol,消耗KIO3的物质的量为0.6mol×![]() =0.12mol,则共加入KIO3的物质的量为1mol+0.12mol=1.12mol,故答案为:1.12或0.4;
=0.12mol,则共加入KIO3的物质的量为1mol+0.12mol=1.12mol,故答案为:1.12或0.4;
(4).向100mL 1mol/L的KIO3溶液中滴加NaHSO3溶液,HSO3-被氧化为SO42-,开始时KIO3过量,由于氧化性IO3->I2,则KIO3反应时不能生成I-,而是生成I2,反应离子方程式为:2IO3-+5HSO3-=I2+5SO42-+H2O+3H+,故答案为:2IO3-+5HSO3-=I2+5SO42-+H2O+3H+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在一隔热系统中,向20.00mL 0.01000molL﹣1的醋酸溶液中逐滴加入0.01000mol.L﹣1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( ) 
A.若a点溶液呈酸性,则a点有:c(CH3COO﹣)>c(Na+)>c(CH3COOH)
B.从b到c: ![]() 逐渐增大
逐渐增大
C.水的电离程度:b点<c点
D.b点有0.01000mol?L﹣1+c(H+)=c(Na)+﹣c(CH3COOH)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有()个
①将铁屑放入稀HNO3中,证明Fe比H2活泼
②FeCl3腐蚀Cu 制印刷电路板是由于铁比铜的金属性强
③检验溶液中是否含有Fe2+,取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN 溶液,观察实验现象
④磁性氧化铁溶于稀硝酸的离子方程式为:3Fe2++4H++NO3-==3Fe3++NO↑+3H2O
⑤将NaOH浓溶液滴加到饱和的FeCl3溶液中,制备Fe(OH)3胶体
⑥氢氧化铁与HI溶液反应的离子方程式为: Fe(OH)3+3H+==Fe3++3H2O
⑦铁与水蒸气在高温下的反应产物为Fe2O3 和H2
⑧1mol FeI2与足量氯气反应时转移的电子数为3NA
⑨检验Fe (NO3)2晶体是否氧化变质的方法是将Fe (NO3) 2样品溶于稀H2SO4后,滴加KSCN 溶液,观察溶液是否变红
⑩图示装置能较长时间观察到Fe (OH) 2白色沉淀
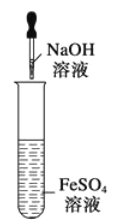
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 烧碱、纯碱、熟石灰均属于碱,稀豆浆、FeCl3溶液、蛋白质溶液均属于胶体
B. SO2、NO2、CO2等非金属氧化物都是酸性氧化物
C. 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
D. 葡萄糖溶液和淀粉溶液的本质区别是能否产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( ) 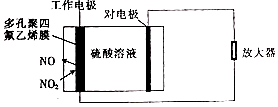
A.“对电极”是负极
B.“工作电极”上发生的电极反应为NO2+2e﹣+2H+═NO+H2O
C.传感器工作时H+由工作电极移向对电极
D.对电极的材料可能为活泼金属锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AgCl、AgBr及AgI的Ksp依次为1.6×10﹣10、4.8×10﹣13和1.6×10﹣16 , 现将物质的量均为1.5×10﹣2mol的NaI,NaBr、NaCl和4.0×10﹣2mo1AgNO3混合配成1.0L水溶液,达到平衡时,下列说法正确的是( )
A.只生成AgBr及AgI两种沉淀
B.溶液中c(I﹣)≈1.0×10﹣9mol/L
C.溶液中c(Br﹣)≈3.0×10﹣5mol/L
D.溶液中c(Ag+)≈3.2×10﹣8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗等物质的量浓
度的AgNO3溶液的体积比为1:1:1,则上述溶液的体积比为 ( )
A. 6:3:2 B. 3:2:1 C. 1:1:1 D. 9:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
A. 颜色都呈红褐色
B. 能透过半透膜
C. 分散质颗粒直径都在1~100 nm之间
D. 加入浓氢氧化钠溶液都产生红褐色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com