
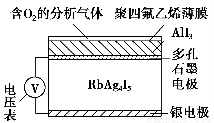
固体电解质通过其中的离子迁移进行电荷传递,因此又称为固体离子导体,RbAg4I5晶体就是一种重要的固体电解质,其中发生迁移的物质全是Ag+。利用RbAg4I5晶体,可以制成电化学气敏传感器,如图是一种测定O2含量的气体传感器示意图。被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势的变化可以得知O2的含量。在气体传感器的工作过程中,下列变化肯定没有发生的是 ( )。
A.I2+2Rb++2e-=2RbI
B.I2+2Ag++2e-=2AgI
C.Ag-e-=Ag+
D.4AlI3+3O2=2Al2O3+6I2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014年化学高考题型专练十二 常见无机物的性质及其综合应用练习卷(解析版) 题型:选择题
下列类推正确的是( )。
A.CaCO3与稀硝酸反应生成CO2,CaSO3也能与稀硝酸反应生成SO2
B.铜在氯气中剧烈燃烧生成二价铜,铜也能在硫蒸气中剧烈燃烧生成二价铜
C.锌可以与溶液中的银离子发生置换反应,钠也能与溶液中的银离子发生置
换反应
D.钠与乙醇反应产生氢气,钾与乙醇也能反应产生氢气
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练八 化学反应速率和化学平衡分析与判断练习卷(解析版) 题型:选择题
合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

下列说法正确的是 ( )。
A.由图1可得加入适当的催化剂,E和ΔH都减小
B.图2中0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,
从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d
C.图3中A、B、C三点所处的平衡状态中,反应物N2的转化率最高的是B点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练二 化学常用计量的理解和综合应用练习卷(解析版) 题型:选择题
如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为 ( )。

A.2∶7 B.5∶4 C.2∶1 D.7∶2
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练三 特定条件下离子方程式的书写与判断练习卷(解析版) 题型:选择题
下列离子方程式书写正确的是 ( )。
A.澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3—=CaCO3↓+CO32—+2H2O
B.磁性氧化铁置于氢碘酸溶液中:Fe3O4+8HI=2Fe3++Fe2++4H2O+8I-
C.NaHSO4溶液中滴加过量Ba(OH)2溶液:H++SO42—+Ba2++OH-=BaSO4↓+H2O
D.醋酸与氨水混合:CH3COOH+NH3·H2O=CH3COONH4+H2O
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练七 电化学理论的分析及应用练习卷(解析版) 题型:选择题
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是 ( )。

A.X为直流电源的正极,Y为直流电源的负极
B.阴极的电极反应式为2H++2e-=H2↑
C.该过程中的产品主要为H2SO4和H2
D.图中的b>a
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练一 化学与科学技术社会环境的关系练习卷(解析版) 题型:选择题
化学与人类生活、生产及社会可持续发展密切相关,下列说法正确的是( )。
A.发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔
B.“天宫一号”使用的碳纤维是一种新型的有机高分子材料
C.加速矿物资源开采,促进地方经济发展
D.自来水厂常加入FeSO4和Cl2处理水,能同时达到杀菌、消毒和聚沉水体中悬浮物的目的
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练 7-3化学平衡常数化学反应进行方向练习卷(解析版) 题型:填空题
已知可逆反应:A(g)+B(g) C(g)+D(g) ΔH<0。请回答下列问题:
C(g)+D(g) ΔH<0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(A)=1 mol/L,c(B)=2.4 mol/L,达到平衡时,A的转化率为60%,此时B的转化率为 。
(2)若反应温度降低,则B的转化率将 (填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(A)=4 mol·L-1,c(B)= a mol·L-1,达到平衡后c(C)=2 mol·L-1,则a= 。
(4)若反应温度不变,反应物的起始浓度分别为c(A)=c(B)=b mol/L,达到平衡后c(D)= 。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 9-1原电池 化学电源练习卷(解析版) 题型:填空题
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):

(1)对于氢氧燃料电池,下列表达不正确的是 。
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100 mL 0.1 mol·L-1 AgNO3溶液,当氢氧燃料电池中消耗氢气112 mL(标准状况下)时,此时图中装置中溶液的pH= (溶液体积变化忽略不计)。
Ⅱ.已知甲醇的燃烧热ΔH为-726.5 kJ·mol-1,在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式为 。
理想状态下,该燃料电池消耗1 mol甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为 (燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com