
【题目】下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.向水中加入少量稀硫酸,c(H+)增大,KW不变
C.向水中加入氨水,水的电离平衡向正反应方向移动,c(OH﹣)增大
D.pH=3的醋酸溶液,稀释至10倍后pH=4
【答案】B
【解析】解:A.无论pH大小,纯水都呈中性,95℃纯水的pH<7,但纯水仍然呈中性,故A错误;
B.水中加入稀硫酸,c(H+)增大,离子积常数只与温度有关,温度不变,水的离子积常数不变,故B正确;
C.向水中加入氨水,c(OH﹣)增大,抑制水电离,水的电离平衡逆向移动,故C错误;
D.醋酸是弱电解质,醋酸溶液中存在电离平衡,所以pH=3的醋酸溶液,稀释至10倍后溶液中氢离子浓度大于原来的 ![]() ,所以稀释有溶液的pH<4,故D错误;
,所以稀释有溶液的pH<4,故D错误;
故选B.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)CO2(g)+H2(g)△H>0
试回答下列问题:
(1)请写出该化学反应的平衡常数表达式: .
(2)830K温度下,若起始时c(CO)=2molL﹣1 , c(H2O)=3molL﹣1 , 达到平衡时CO的转化率为50%,则在该温度下,该反应的平衡常数K= .
(3)若降低温度,该反应的K值将 , 该反应的正反应速率将; 该反应的逆反应速率将(均填“增大”“减小”或“不变”).
(4)若要提高CO的转化率,可采取的措施有: .
(5)830K温度下,若起始时c(CO)=1molL﹣1 , c(H2O)=2molL﹣1 , 反应进行一段时间后,测得H2的浓度为0.5molL﹣1 , 则此时该反应是否达到平衡状态(填“是”与“否”),你判断的依据是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A.
表示10 mL 0.01molL﹣1KMnO4酸性溶液与过量的0.1molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
B.
表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.
表示示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
D.
表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.淀粉、纤维素、蛋白质均为高分子
B.麦芽糖属于双糖,能发生银镜反应
C.油脂、氨基酸、蔗糖都能发生水解
D.通常情况下,强酸、强碱或高温条件均可使酶失去活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6 ![]() 2CH3CH2OH+2CO2↑).
2CH3CH2OH+2CO2↑).
Ⅰ、已知:实验室制乙烯原理为CH3CH2OH ![]() CH2=CH2↑+H2O,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用下列实验验证.(气密性已检验,部分夹持装置略).
CH2=CH2↑+H2O,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用下列实验验证.(气密性已检验,部分夹持装置略).
实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 |
… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有性.
(2)分析,甲认为是C2H4 , 乙认为不能排除SO2的作用.
①根据甲的观点,使B中溶液褪色反应的化学方程式是;
②乙根据现象认为实验中产生的SO2和 , 使B中有色物质反应褪色.
(3)为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色.
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色.
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是;乙设计的实验D中盛放的试剂是 , 装置连接顺序为 .
b.能说明确实是SO2使E中溶液褪色的实验是 .
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是 . 由此可得出的干燥的SO2 不能使Br2 的四氯化碳溶液褪色
Ⅱ、葡萄酒中常用Na2S2O5做抗氧化剂.
(4)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图所示.写出Na2S2O5溶于水时发生的化学方程式 . 
(5)已知:Ksp[BaSO4]=1×10﹣10 , Ksp[BaSO3]=5×10﹣7 . 把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42﹣沉淀完全[c(SO42﹣)≤1×10﹣5molL﹣1],此时溶液中c(SO32﹣)≤molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于某温度下一定浓度氨水的说法正确的是( )
A.NH3?H2O电离达到平衡的标志是溶液呈电中性
B.![]() 是个常数
是个常数
C.氨水促进了水的电离
D.c(NH ![]() )+c(H+)=c(NH3?H2O)+c(OH﹣)
)+c(H+)=c(NH3?H2O)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某温度下,Ksp(AgCl)=1.8×10﹣10 , Ksp (Ag2CrO4)=1.9×10﹣12 , 故Ag2CrO4更难溶
B.在CaCO3饱和溶液中,加入CaCl2固体,沉淀溶解平衡逆向移动,溶液中Ca2+浓度减小
C.溶度积常数Ksp与温度有关,温度越高,溶度积越大
D.在AgCl饱和溶液中,加入AgCl固体,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3在化学定量分析中常用作基准物质,遇酸易分解;实验室制备原理为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2 . 实验装置如下:
3Na2S2O3+CO2 . 实验装置如下: 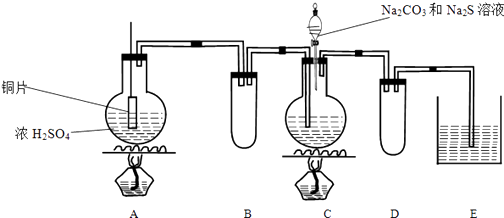
(1)A中发生反应的化学方程式是: .
(2)E中所盛试剂作用是;若要停止A中的化学反应,还可以采取的操作是 .
(3)B和D装置作用:
(4)甲同学在加热A后,发现液面下的铜丝变黑.该同学对黑色生成物提出如下假设:
①可能是CuO;②可能是Cu2O;③可能是CuS
乙同学认为假设②一定不成立,依据是 .
该同学设计实验进一步验证黑色物质的组成:
基于上述假设分析,黑色物质的组成为(填化学式) .
(5)C中通入SO2不能过量原因是 .
(6)实验室用硫代硫酸钠溶液吸收残余氯气生成SO42﹣ , 其反应的离子方程式是:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一,铁及其化合物在现代社会各个领域仍有广泛的应用.
I.氧化物﹣Fe2O3:用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:
已知:HCl(浓)+FeCl3HFeCl4 . 试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
①Ca2+、Mn2+、Cu2+等杂质离子主要在(填“水”或“有机”)相.
②若实验时共用萃取剂X 150mL,萃取率最高的方法是(填字母).
a.一次性萃取,150mL b.分2次萃取,每次75mL c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是(写化学式);反萃取能发生的原因是 .
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是 .
(4)测定产品中铁的含量需经酸溶、还原为Fe2+ , 然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+ , 写出该滴定反应的离子方程式 .
(5)II.含氧酸盐﹣铁酸铜(CuFe2O4)是很有前景的热化学分解水制氢的材料,CuFe2O4在制氢过程中可以循环使用.在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4﹣a),氧缺位值(a)越大,活性越高,制氢越容易.
根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式 .
(6)课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=(结果保留小数点后2位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com