
用NA表示阿伏伽德罗常数,下列叙述正确的是
A.标准状况下,22.4 L H2O含有的分子数为1NA
B.常温常压下,1.06 g Na2CO3含有的分子数为0.02 NA
C.标准状况下,NA个CO2分子占有的体积约为22.4 L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl—个数为1NA
 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
下列各项化学用语中表示正确的是( )
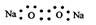
A.Na2O2的电子式为:
B.丙烷分子的比例模型为:
 C.甲醛的结构简式:HCHO D.聚丙烯的结构简式为:
C.甲醛的结构简式:HCHO D.聚丙烯的结构简式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
某浓度的氨水中存在下列平衡:NH3·H2O NH
NH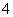 +OH-,若想增大NH
+OH-,若想增大NH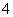 的浓度,而不增大OH-的浓度,应采取的措施是
的浓度,而不增大OH-的浓度,应采取的措施是
A.适当升高温度 B.加入NaOH固体
C.通入NH3 D.加入NH4Cl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知C(s)+CO2(g) == 2CO(g) △H>0, 反应速率为 ,
,
Zn(s)+2HCl(aq)== ZnCl2 (aq)+H2(g) H<0,反应速率为
H<0,反应速率为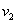 ,
,
对于上述反应,当温度升高时, 和
和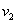 的变化情况为
的变化情况为
A.同时增大 B.同时减小 C. 增大
增大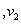 减小 D.
减小 D. 减小
减小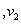 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃、101 kPa下,稀的强酸与强碱溶液反应的中和热为57.3 kJ/mol。
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程: 。
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。
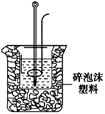 ①实验时所需的玻璃仪器除烧杯、量筒外还需: 。
①实验时所需的玻璃仪器除烧杯、量筒外还需: 。
②该装置中有一处错误是: ,如果用该错误
装置测定,结果会 (填“偏高”“偏低”“无影响”)
③如果该生用50 mL 0.25 mol/L的稀硫酸与50 mL 0.55 mol/L的稀烧
碱溶液,他用试剂的用量的理由是: 。在该实验中需要测
定某种数据,完成一次实验,需要测定该数据的次数为 次。使用正确的装置进
行实验,取上述溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中
和后生成的溶液的比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得
中和热△H=
查看答案和解析>>
科目:高中化学 来源: 题型:
对于溶液中某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO42-
D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+,MnO4—→Mn2+,Cl2→Cl—,HNO3→NO。如果分别用等物质的量的这些粒子氧化足量的KI,得到I2最多的是( )
A.Fe3+ B.MnO4— C.Cl2 D.HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与实验相关的叙述正确的是( )
A. 钠在氯气中燃烧,产生白色的烟雾
B. 除去NaHCO3溶液中混有的少量Na2CO3,可加入适量的NaOH
C. 配制溶液时,若加水超过容量瓶刻度,应该重新配制
D. 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中一定能判断某化学平衡发生移动的是( )
|
| A. | 混合物中各组分的浓度发生改变 | B. | 正、逆反应速率发生改变 |
|
| C. | 反应物的转化率发生改变 | D. | 混合体系的压强发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com