
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+,MnO4—→Mn2+,Cl2→Cl—,HNO3→NO。如果分别用等物质的量的这些粒子氧化足量的KI,得到I2最多的是( )
A.Fe3+ B.MnO4— C.Cl2 D.HNO3
科目:高中化学 来源: 题型:
铁镍蓄电池又称爱迪生电池,放电时的总反应为: Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是 ( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-= Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应:C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数,下列叙述正确的是
A.标准状况下,22.4 L H2O含有的分子数为1NA
B.常温常压下,1.06 g Na2CO3含有的分子数为0.02 NA
C.标准状况下,NA个CO2分子占有的体积约为22.4 L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl—个数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中,在溶液中能大量共存,加入氢氧化钠溶液有沉淀析出,加入稀盐酸有气体放出的是 ( )
A.Na+、Ca2+、SO42-、CO32- B.Na+、Ca2+、HCO3-、NO3--
C.K+、Al3+、SO42-、NO3- D.K+、Na+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氨水溶液的质量分数越大时,其溶液的密度越小,将80%和20%的两种氨水溶液等体积混合后,溶液的质量分数为( )。
A.大于50% B.等于50% C.小于50% D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是
A.Na2O2 、HClO 、SO2等物质都具有漂白作用
B.液氨、液态氯化氢都是电解质
C.置换反应都是氧化还原反应,复分解反应都是非氧化还原反应
D.明矾能水解生成氢氧化铝胶体,可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。
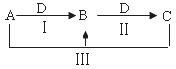
(1)若A为氯碱工业(以电解食盐水生产氯气、氢气和烧碱)的产品,C为厨房中的用品。
① D的化学式是 。
② 反应Ⅲ的离子方程式是 。
③ 氯碱工业制备A的化学方程式是 ,其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1 mol KI转移电子0.6 mol,则三种物质间反应的离子方程式是 。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是 。
②鉴别B、C常用的一种试剂是 ; B可作净水剂,其原理
是: (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应 2A+B⇌2C;△H<0达到化学平衡时,根据以下条件改变填空:
(1)若A、B、C都是气体,且C为有色气体.
①及时分离出C,平衡 正向 移动;(填正向、逆向、不)
②使密闭容器体积增大,A的转化率 减小 ;(填增大、减小、不变)
③如果升高温度,平衡混合物的颜色 变浅 ;(填加深、变浅、不变)
④加入催化剂D,平衡 不变 移动;(填正向、逆向、不)
(2)若A、C为气体,B为固体;
①加压,则A的体积分数 不变 ;(填增大、减小、不变)
②增加B的量,A的转化率 不变 .(填增大、减小、不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com