
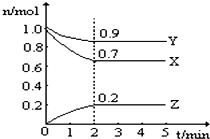
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)分析图象计算Z的消耗物质的量为0.2mol,结合反应速率概念计算,V=$\frac{△c}{△t}$;
(3)①由实验数据可知,Ⅱ、Ⅲ中接触面积不同,I、Ⅱ中温度不同;
②Ⅰ和Ⅱ表明,温度高的反应时间少;
③Ⅱ、Ⅲ中接触面积不同,接触面积大的反应时间少;
④证明盐酸的浓度对该反应的速率的影响,利用相同的Zn与不同浓度的盐酸反应.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)图象计算Z的消耗物质的量为0.2mol,从开始至2min,Z的平均反应速率=$\frac{0.2mol}{2L×2min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(3)①由实验数据可知,Ⅱ、Ⅲ中接触面积不同,I、Ⅱ中温度不同,则该实验的目的是探究固体表面积、温度对锌和稀盐酸反应速率的影响,
故答案为:固体表面积;温度;
②Ⅰ和Ⅱ表明,温度高的反应时间少,则表明温度越高,反应速率越大,
故答案为:温度越高;
③Ⅱ、Ⅲ中接触面积不同,接触面积大的反应时间少,则能表明固体的表面积对反应速率有影响的实验编号是Ⅱ和Ⅲ,实验结论是其他因素不变,固体表面积越大,反应速率越快,
故答案为:Ⅱ;Ⅲ;
④证明盐酸的浓度对该反应的速率的影响,利用相同的Zn与不同浓度的盐酸反应,则设计实验为在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应,
故答案为:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
点评 本题考查化学反应速率的影响因素,为高考常见题型和高频考点,把握常见外界因素对反应速率的影响为解答的关键,侧重分析与实验能力的考查,注意相关基础知识的积累,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 主要成分都是蛋白质 | B. | 都是高分子化合物 | ||
| C. | 可用灼烧的方法区别二者 | D. | 二者成分不同,但燃烧产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com