
【题目】已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答下列问题:
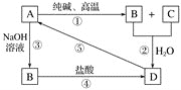
(1)写出化学式:A是____________,D是____________。
(2)写出相关反应的化学方程式:①____________,⑤____________。
(3)写出相关反应的离子方程式:②__________,③__________,④__________。
【答案】SiO2 H2SiO3 Na2CO3+SiO2![]() Na2SiO3+CO2↑ H2SiO3
Na2SiO3+CO2↑ H2SiO3![]() H2O+SiO2 CO2+H2O+SiO32-=CO32-+H2SiO3↓ SiO2+2OH-=SiO32-+H2O SiO32-+2H+=H2SiO3↓
H2O+SiO2 CO2+H2O+SiO32-=CO32-+H2SiO3↓ SiO2+2OH-=SiO32-+H2O SiO32-+2H+=H2SiO3↓
【解析】
A是一种不溶于水的固体非金属氧化物,且A能够与纯碱(Na2CO3)、NaOH反应,A应该为SiO2;由转化关系可知B为Na2SiO3,C为CO2,D为H2SiO3,据此进行解答。
A是一种不溶于水的固体非金属氧化物,且A能够与纯碱(Na2CO3)、NaOH反应,A应该为SiO2;由转化关系可知B为Na2SiO3,C为CO2,D为H2SiO3,③为SiO2和NaOH的反应,Na2SiO3可与酸反应生成硅酸,硅酸加热分解生成二氧化硅,则
(1)由以上分析可知:A为SiO2,D为H2SiO3;
(2)①是SiO2和碳酸钠在高温下反应生成硅酸钠和二氧化碳,反应的方程式为Na2CO3+SiO2![]() Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
⑤是硅酸加热分解生成二氧化硅,反应的化学方程式为H2SiO3![]() H2O+SiO2;
H2O+SiO2;
(3)②硅酸酸性比碳酸弱,硅酸钠和二氧化碳、水反应可生成硅酸,反应的离子方程式为CO2+H2O+SiO32-=CO32-+H2SiO3↓;
③是二氧化硅和氢氧化钠反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O;
④是硅酸钠和盐酸反应生成硅酸,反应的离子方程式为SiO32-+2H+=H2SiO3↓。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )
A.Na2CO3是氧化物B.Na2CO3是盐
C.Na2CO3是钠盐D.Na2CO3是碳酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列三种溶液:①45%的乙醇溶液、②汽油和氯化钾溶液、③氯化钠和单质碘的水溶液,分离上述各组混合液的正确方法依次是( )
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、分液、萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH关系如下图所示。下列说法正确的是( )

A. H3AsO3的电离常数Ka1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)I的最高化合价为__________,K的元素名称为__________。
(2)写出基态时Q元素原子的电子排布式__________,J元素原子的外围电子排布式________________。
(3)下列对比正确的是__________。
a.原子半径H>G>B>A
b.第一电离能E>D>C>B
c.电负性A>H>G>Q
d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是__________。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
【答案】 +6 铜 1s22s22p63s23p63d104s24p1 3d64s2 cd bc
【解析】试题分析:(1)I是Cr元素,价电子排布是3d54s1;K是29号元素Cu;(2)Q是31号元素Ga;(3)电子层数越多半径越大,电子层数相同时,质子数越多半径越小;同周期元素从左到右第一电离能增大,N元素2p能级为半充满状态,第一电离能大于相邻的O元素;同周期元素从左到右电负性增强,同主族元素从上到下电负性减小;非金属性越强,最高价氧化物的水化物酸性越强;(4)L是Rb元素,位于元素周期表第五周期ⅠA族,价电子排布是5S1;Ⅷ族的元素,属于d区元素;M的外围电子排布式为5d106s1;H所在族的位ⅣA族,外围电子排布式为ns2np2,属于p区元素;
解析:(1)I是Cr元素,价电子排布是3d54s1,所以最高化合价为+6;K是29号元素Cu,名称是铜;(2)Q是31号元素Ga,核外电子排布式是1s22s22p63s23p63d104s24p1;(3)电子层数越多半径越大,电子层数相同时,质子数越多半径越小,原子半径G>H>A>B,故a错误;同周期元素从左到右第一电离能增大,N元素2p能级为半充满状态,第一电离能大于相邻的O元素,所以第一电离能Ne>F>N>O,故b错误;同周期元素从左到右电负性增强,同主族元素从上到下电负性减小,所以电负性A>H>G>Q,故c正确;非金属性越强,最高价氧化物的水化物酸性越强,最高价氧化物的水化物酸性HNO3>H2CO3>H2SiO3>Al(OH)3,故d正确;(4)L是Rb元素,位于元素周期表第五周期ⅠA族,价电子排布是5S1,属于s区元素,故a正确;Ⅷ族的元素,属于d区元素,O位于元素周期表第七周期Ⅷ族,属于d区元素,故b错误;M的外围电子排布式为5d106s1,故c错误;H所在族的位ⅣA族,外围电子排布式为ns2np2,属于p区元素,故d正确。
点睛:同周期元素从左到右第一电离能增大,ⅤA族元素p能级为半充满状态,能量低,第一电离能大于相邻的ⅥA族元素,如第二周期的N元素第一电离能大于O。
【题型】综合题
【结束】
23
【题目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素原子基态电子排布式 。
(2)用电子排布图表示F元素原子的价电子构型 。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为 。
(4)离子半径D+ B3—,第一电离能B C,电负性C F
(填“<”、“>”或“=”)。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比1∶1,X的电子式为 ,试写出Cu、稀H2SO4与X反应制备硫酸铜的离子方程式 。
(6)写出E与D的最高价氧化物对应的水化物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl据此,某学生设计了下列实验。
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
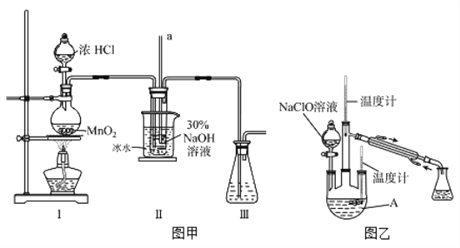
(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol·L-1的I2溶液滴定。已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1120mL的烧瓶里充满NO2和O2的混合气体,然后将其倒扣于水槽中,可以看到液体充满烧瓶(气体体积已折算成标况下的体积),下列说法正确的是
A. NO2与O2的体积分别为896mL和224mL
B. 总反应式:NO2+O2+H2O=HNO3
C. 转移的电子数为0.02mol
D. 有NO气体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所表示的方法研究金属钠与水反应的性质,其中A是用带孔的铝箔包着的小块的金属钠.

(1)从大块钠上取下的小块钠要用滤纸擦一擦,这样做的目的是_______________。
(2)包裹钠块的铝箔要预先扎上足够多的小孔,若孔数不够,可能出现的不良后果是__________.假如在实验刚开始就将镊子松开拿出水面,A表现出的现象是 _______________________,出现这种现象的原因是______________。
(3)据预测,钠与水反应生成氢气和氢氧化钠.
证明生成氢氧化钠的实验方法和相应的现象是______________________;
(4)已知反应结束后铝箔和钠均消失,请写出相关反应的离子方程式:______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】农药波尔多液可用于水果灭虫,是由石灰水和硫酸铜溶液混合而成的悬浊液。它不能用铁制容器盛放,是因为铁与该农药中的硫酸铜起反应。在该反应中,对铁的叙述错误的是( )
A. 铁发生还原反应B. 铁发生氧化反应
C. 铁是还原剂D. 铁失去电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com