
【题目】在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是

A.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
B.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】室温下,将一定浓度的一元酸HA溶液和一定浓度的NaOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度(mol/L) | 反应后溶液的pH | |
|
| ||
① | 0.1 | 0.1 | 9 |
② |
| 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应的溶液中:![]()
B.实验①反应的溶液中:![]()
C.实验②反应的溶液中:![]()
D.实验②反应的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的烧碱溶液,溶液中水所电离的c水(H+)随加入烧碱溶液体积的变化如图所示,下列说法正确的是( )
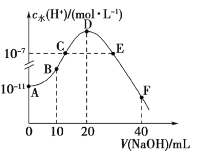
A.B点的溶液中粒子浓度之间存在:c(HA)>c(Na+)>c(A-)
B.由图可知A-的水解平衡常数Kh约为1×10-9
C.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
D.F点的溶液呈碱性,粒子浓度之间存在:c(OH-)=c(HA)+c(A-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
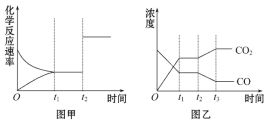
①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达,正确的是
A.钠投入水中的离子方程式: Na+2H2O=Na++2OH-+H2↑
B.一水合氨的电离方程式: NH3H2O![]() NH4++OH-
NH4++OH-
C.硫酸铜溶液和氢氧化钡溶液反应的离子方程式反应:Ba2++SO42=BaSO4↓
D.氯气溶于水的离子方程式:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,海水资源开发和利用是化学研究的一项重要任务。如图是某化工厂对海水资源综合利用的示意图,有关叙述正确的是( )
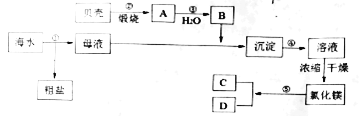
A.上述流程中步骤②~⑤涉及的化学反应包含四种基本反应类型
B.工业上冷却电解无水氯化镁所得的镁蒸气时,选择氩气或氮气
C.步骤④中加入的化学试剂可以为硝酸
D.从步骤④得到的溶液中获得的六水合氯化镁晶体,采用蒸发结晶的方式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲探究NH3的催化氧化反应,按如图装置进行实验。A、B装置可选用的药品:浓氨水、H2O2溶液、蒸馏水、NaOH固体、MnO2。

(1)NH3催化氧化的化学方程式是____。
(2)甲、乙两同学分别按如图装置进行实验。一段时间后,装置G中的溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是___。
②乙观察到装置F中只有白烟生成,白烟的成分是___(填化学式)。
③用离子方程式解释装置G中溶液变成蓝色的原因:___。
(3)为帮助乙实现在装置F中也观察到红棕色气体,如何改进___。
(4)为实现该反应,也可用如图所示的装置替换原装置中虚线框部分。
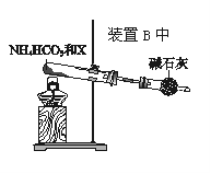
化合物X为__;NH4HCO3的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从一瓶放置较长时间的![]() 溶液中取出20mL,向该溶液中逐滴加入
溶液中取出20mL,向该溶液中逐滴加入![]() 盐酸至过量,反应产生的
盐酸至过量,反应产生的![]() 气体的物质的量与加入盐酸的体积关系如图所示(忽略
气体的物质的量与加入盐酸的体积关系如图所示(忽略![]() 溶解和
溶解和![]() 挥发),请回答下列问题:
挥发),请回答下列问题:

(1)O-a段发生反应的离子方程式为______________________,______________________。
(2)O点溶液中所含溶质的物质的量为___________,___________。
(3)原![]() 溶液的物质的量浓度为_____________。
溶液的物质的量浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为________L,NO2的体积为________L。
(2)参加反应的HNO3的物质的量是________。
(3)待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
(5)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通O2______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com