
【题目】常温下,向20mL0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的烧碱溶液,溶液中水所电离的c水(H+)随加入烧碱溶液体积的变化如图所示,下列说法正确的是( )
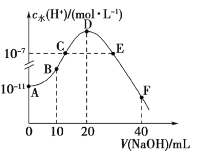
A.B点的溶液中粒子浓度之间存在:c(HA)>c(Na+)>c(A-)
B.由图可知A-的水解平衡常数Kh约为1×10-9
C.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
D.F点的溶液呈碱性,粒子浓度之间存在:c(OH-)=c(HA)+c(A-)+c(H+)
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在水溶液中橙色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O![]() 2CrO42-+2H+把重铬酸钾K2Cr2O7溶于水配成的稀溶液是橙色的.
2CrO42-+2H+把重铬酸钾K2Cr2O7溶于水配成的稀溶液是橙色的.
(1)向上述溶液中加入NaOH溶液,溶液呈 ______ 色
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈 ______ 色
(3)向原溶液中逐渐加入足量硝酸钡溶液![]() 已知BaCrO4为黄色沉淀
已知BaCrO4为黄色沉淀![]() ,则平衡 ______
,则平衡 ______ ![]() 填“向左移动”或“向右移动”
填“向左移动”或“向右移动”![]() ,溶液颜色将 ______ .
,溶液颜色将 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。回答有关中和反应的问题。
(1)用0.1 mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出_______kJ热量。
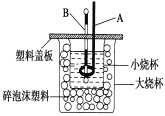
(2)如图装置中仪器A的名称是____________,碎泡沫塑料的作用是_____________________________;要重复进行三次实验的目的是 ____________________。
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填“偏大”、“偏小”、“无影响”)。
(4)将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是_____。
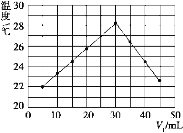
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定一定条件下气体的体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低。回答下列问题:

(1)写出锌和稀硫酸反应的化学方程式:__________________________________。
(2)已知:该条件下H2的密度为0.087 0 g·L-1,如果甲管的刻度最大值是100 mL,则实验中称取锌片的最大质量是__________g。
(3)为了准确地测量H2的体积,在读取反应后甲管中液面的读数时,应注意________(填写序号)。
A.视线与凹液面最低处相平
B.等待片刻,待乙管液面不再上升时读数
C.读数时应上、下移动乙管,使甲、乙两管液面相平
D.读数不一定使甲、乙两管液面相平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在27.5 g水中溶解12.5 g CuSO45H2O,恰好达到饱和,该溶液密度为1.18 g·cm-3,求:
(1)该溶液中阴阳离子的总物质的量._________________
(2)该溶液中CuSO4的物质的量浓度(保留二位小数)。________________
(3)取出20.0 mL该溶液,加入足量Ba(OH)2溶液,反应后可得到沉淀质量多少克?(保留一位小数)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:(已知N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol)
2NH3(g) △H=-92.4kJ/mol)

下列说法正确的是( )
A.2c1>c3B.a+b<92.4C.2p1<p3D.a1+a3<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:
A.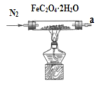 B.
B. C.
C. D.
D. E.
E.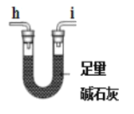
①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→___→尾气处理装置(仪器可重复使用)。
②检查装置气密性后,先通入一段时间N2,其目的为__。
③实验证明了气体产物中含有CO,依据的实验现象为__。
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是__。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为__。
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为__。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为__;步骤3中加入锌粉的目的为___。
(5)若步骤![]() 配制溶液时部分Fe2+被氧化变质,则测定结果将__(填“偏高”、“偏低”或“不变”)
配制溶液时部分Fe2+被氧化变质,则测定结果将__(填“偏高”、“偏低”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH <0,某研究小组研究了其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是

A.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
B.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题。

(1)从实验装置上看,图中有一处仪器未画出的是_____________________。
(2)在其他操作正确的前提下,提高中和热测定准确性的关键是____________。大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大”“偏小”或“无影响”)
(3)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将______(填“偏大”、“偏小”、“不变”);原因是___________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的生成1 mol液态水时放出热量的数值_______________(填“偏大”、“偏小”、“不变”)。
(5)实验中NaOH过量的目的是___________。
(6)若某同学利用上述装置做实验有些操作不规范,造成测得中和热偏小,请分析可能原因(________)。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.用量筒中的氢氧化钠溶液倒入小烧杯时动作缓慢
C.在量取盐酸时仰视读书
D.大烧杯的盖板中间小孔太大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com